Podstawowe prawa chemii. Podstawowe pojęcia i prawa chemii
Nie będzie zbyteczne definiowanie terminu " chemia " - jest to najważniejsza nauka, która bada strukturę substancji, ich przemiany. Obejmuje następujące podstawowe pojęcia i prawa (chemia):
1. Właściwości chemiczne jakiejkolwiek substancji ustala się na podstawie stanu skorup elektronowych (zewnętrznych) cząsteczek, tworzących je atomów. Jądra i wewnętrzne elektrony pozostają prawie niezmienione podczas procesów chemicznych.
2. Przedmiot chemii - pierwiastki chemiczne, ich kombinacje (atomy, proste, złożone: jony, karbeny, wolne rodniki, cząsteczki, jony rodnikowe, a także materiały, związki chemiczne, ich związki: skupiska, klatraty, związki, solwaty itp. ). Jest ich ogromna liczba i stale rośnie, ponieważ sama nauka stanowi przedmiot (około 10 milionów związków chemicznych jest już znanych).
3. Substancja jest rodzajem materii o pewnej masie odpoczynku i składającej się z takich cząstek elementarnych, jak elektrony, neutrony, protony, mezony itp. Nauka ta bada takie substancje, które są przekształcane w atomy, jony, cząsteczki i rodniki. Są to: złożone, proste (związki chemiczne).
4. Najmniejszy składnik pierwiastka chemicznego, który nie może być rozdzielony chemicznie i który zachowuje wszystkie pierwotne właściwości określone przez powłokę elektryczną i ładunek jądrowy nazywany jest atomem . Część substancji (związku) zawierająca identyczne atomy nazywana jest pierwiastkiem chemicznym , z których każdy odpowiada kompleksowi pewnych atomów.
5. Cząsteczka jest mikrocząsteczką, która ma 2 lub więcej atomów i jest zdolna do autonomicznego istnienia. Ma stały ilościowy, jakościowy skład jąder atomowych, a także stałą liczbę elektronów; wyposażone w wyjątkowe właściwości. 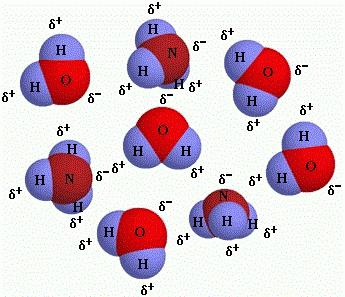
6. Substancje proste są tworzone przez atomy tylko pierwszego pierwiastka chemicznego, w związku z czym stanowią szczególną formę jego istnienia w stanie wolnym (O₂, H₂, He, O₃, S₈), a substancje złożone są tworzone przez różne pierwiastki chemiczne i mogą mieć stały skład ( daltonidy lub związki stechiometryczne) lub zmienne (berthollides lub związki niestechiometryczne).
7. Jony są jednoatomowymi lub wieloatomowymi cząstkami z ładunkiem elektrycznym. Dodatnio naładowane jony są kationami, a ujemnie są anionami. W postaci gazu są w stanie wolnym.
8. Valency to zdolność atomu do zastępowania lub przyłączania innych atomów (grup atomowych) i tworzenia wiązań chemicznych. Miarą walencji jest liczba atomów wodoru (tlenu), które są przyłączone do pierwiastka chemicznego. Wodór jest jednowartościowy, a tlen dwuwartościowy.
9. Reakcje chemiczne to przekształcenie niektórych substancji (związków początkowych) w substancje różnego rodzaju (produkty reakcji), które nie zmieniają jąder atomów.
10. Odczynniki - materiały wyjściowe lub jeden z najbardziej aktywnych związków wyjściowych, który określa kierunek reakcji. 
Pochodzenie omawianego terminu
Istnieją dwa punkty widzenia dotyczące jego pochodzenia:
- Od starożytnego imienia Egiptu - "Hem", co dosłownie tłumaczy się jako "czarny", ciemny ". Prawdopodobnie ze względu na kolor gleby w dolinie r. Neil
- Od starożytnego greckiego terminu "chemeia" - forma sztuki wytapiania metalu.
Nowoczesna nazwa pochodzi od łacińskiego słowa "chimia". Jest międzynarodowa (na przykład w niemieckim chemie, we francuskim chimie, w angielskiej chemii). Wiadomo, że przodkiem terminu "chemia" jest grecki alchemik Zosima (V cent.).
Chemia organiczna: definicja, związki organiczne
Jest to nauka, która bada związki węgla, które są wytwarzane przez żywe organizmy. Do chwili obecnej znanych jest ponad 2 miliony związków organicznych, podzielonych na takie grupy, jak alkeny, alkohole, alkany itp. Większość z nich wchodzi w skład oleju i zajmuje czołowe pozycje w produkcji: barwników, leków, tworzyw sztucznych, kosmetyków .
Skład związków organicznych: atomów węgla i innych pierwiastków (tlenu, wodoru), które są połączone silnymi wiązaniami kowalencyjnymi. Te związki, które powstają z atomów węgla za pomocą wodoru, są nazywane węglowodorami .
Głównym składnikiem gazu ziemnego jest prosty węglowodór (metan - CH₄). Chemia organiczna dokładnie bada związki organiczne zróżnicowane według rodzin i które nazywane są seriami homologicznymi .
Powyższe grupy (alkeny, alkany) należą do różnych serii homologicznych, z których każda zawiera tysiące związków. Ich umiejscowienie w tej serii jest zdeterminowane liczbą atomów węgla wewnątrz cząsteczek (na przykład cząsteczki pierwszych trzech związków szeregu alkanów: metanu - 1 atomu węgla, etanu - 2, propanu - 3).
Nazwy związków zawierających 1 atom węgla zaczynają się od przedrostka "meth", 2 atomy - "et", 3 atomy - "prop." Takie związki, należące do pierwszej serii homologicznej, mają podobne właściwości chemiczne, ale różne właściwości fizyczne. A te związki, które mają niewiele atomów węgla to gazy, dostatecznie duża liczba atomów to ciecze, a ciała stałe są nadmiernie przesycone atomami.
Liczba związków organicznych jest dość duża ze względu na zdolność atomów do tworzenia długich łańcuchów lub pierścieni. Te jednostki strukturalne są ze sobą sklejane ze względu na wiązania kowalencyjne (ich elektrony zewnętrznych powłok są "ogólnie dostępne"). Węgiel tworzy formę prostą (każda para atomowa dzieli między sobą 1 parę elektronów), 2 lub nawet 3 wiązania kowalencyjne (uczestniczą w nich dwie i odpowiednio trzy pary elektronów).
Po reakcji wystarczająco nasyconego związku (organicznego) z innym związkiem, istniejące wiązania są rozbijane, a niektóre atomy są zastępowane przez inne.
Podstawowe stechiometryczne prawa chemii
Są one zawarte w tej sekcji chemii, jako stechiometria. Wiadomo, że zawiera następujące podstawowe prawa chemii:
- Gay-Lussac;
- Avogadro;
- ekwiwalenty i ochrona masy;
- wiele relacji;
- konsystencja kompozycji.
Istota prawa zachowania masy i energii
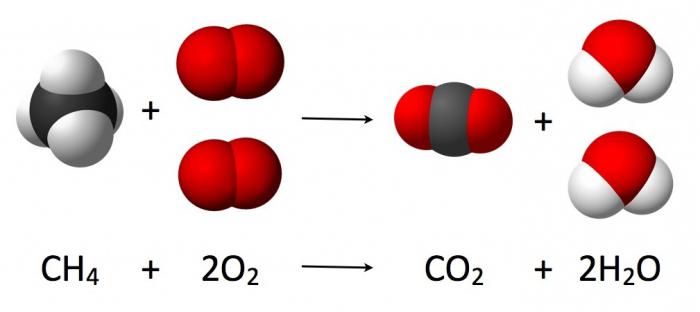
Podstawą tworzenia równań chemicznych jest metoda bilansu materiałowego, której podstawą jest prawo zachowania masy (chemii). Według niego masa odczynników jest identyczna jak masa końcowych produktów reakcji.
Został odkryty przez MV Łomonosowa w 1748 roku. Następnie francuski chemik A. Lavoisier (1789) osiągnął te same wyniki.
Podczas reakcji chemicznej liczba oddziałujących atomów jest niezmienna (obserwuje się tylko ich przegrupowanie, któremu towarzyszy destrukcja substancji wyjściowych). Przepływające oddziaływanie tlenu z wodorem, które prowadzi do tworzenia się wody, można zapisać za pomocą równania odpowiadającej reakcji chemicznej (jak na rysunku poniżej). 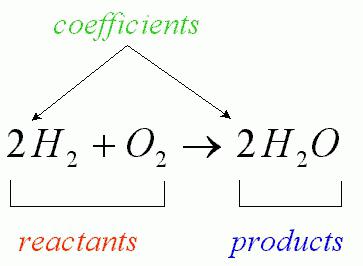
Wzory tych związków chemicznych są współczynnikami określanymi jako "stechiometryczne". Nowoczesna formuła jest odszyfrowana w następujący sposób: suma mas i energii w izolowanym systemie jest stała.
Ma postać: E = m · c², gdzie
c jest prędkością światła (3 · 10⁸ m / s);
Na początku XX wieku Albert Einstein był w stanie udowodnić słuszność tego równania dla jakiejkolwiek postaci.
Istota prawa stałości
Zostało sformułowane przez francuskich chemików J. Prousta i C. L. Bertholleta w 1808 r. Stwierdza ono, że każda indywidualna substancja otrzymana dowolnym znanym sposobem ma zawsze stały skład ilościowy i jakościowy.
Prawo stałości materii (chemii) umożliwiło wyrażanie składu substancji za pomocą znaków chemicznych, odpowiednich wskaźników (np. H₂O, C₂H₅OH, CH₄). Na początku XX wieku (1912-1913) wybitny rosyjski profesor N. S. Kurnakov ujawnił istnienie związków o różnym składzie, które nazwał berthollides .
Jeśli przypomnisz sobie następną lekcję chemii, prawo stałości kompozycji uważa się za sprawiedliwe dla substancji, które mają strukturę molekularną. Jak już wspomniano wcześniej, oprócz substancji o stałym składzie występują również substancje ze zmiennymi: przemienne monolityczne jednostki strukturalne (jony, atomy) postępują z naruszeniem ustalonej okresowości.
Ze względu na obecność związków o różnym składzie, prawo dotyczące stałości składu (chemii) zawiera wyjaśnienia dotyczące faktu, że istnieje bezpośredni związek między strukturą kompozycji związków a metodami ich wytwarzania: jeżeli istnieje struktura molekularna, to kompozycja nie zmienia się w zależności od jakiejkolwiek metody przygotowania, ale w sytuacji, gdy struktura nie jest molekularna (jonowa, atomowa i metalowa) - skład zależy od konkretnych warunków produkcji. 
Prawo do ekwiwalencji tekstu
Został odkryty przez niemieckiego chemika N. Richtera i składa się z następujących: masy substancji, które oddziałują (chemiczne) są równe lub są wielokrotnościami mas ich chemicznych odpowiedników (chemia klasa 11).
Równoważnik to warunkowa lub rzeczywista cząsteczka substancji zdolnych do zastąpienia, uwolnienia, wiązania itp., Która jest równa 1. jonowi wodoru reakcji jonowymiennych lub kwasowo-zasadowych; 1. Elektronowe reakcje redoks.
W inny sposób można powiedzieć, że mol równoważników (pewna ilość substancji zawierającej tyle elementów strukturalnych, ile jest atomów węgla w 12 g izotopu ¹? C) pierwszej substancji reaguje z dokładnie tym samym mole ekwiwalentów, ale z innej substancji .
Matematycznie, to prawo to:
mₐ: Mₔ (A) = mᵦ: Mₔ (B), gdzie
mₐ to masa jakiejś substancji A,
mᵦ jest masą substancji B,
Mₔ (A) jest masą (molową) równoważnika odpowiedniej substancji A,
Mₔ (B) - masa (molowa) odpowiednik substancji B.
Zdarza się, że jedna reagująca substancja początkowo znajduje się w stanie stałym, a druga w stanie gazowym. Następnie rozważane prawo wyraża się następującą formułą:
mₐ: Mₔ (A) = Vb: Vₔ (B).
Istota prawa wielu relacji
Został on opracowany przez angielskiego chemika D. Daltona w 1803 roku. Jego istotą jest to, że w sytuacji, gdy 2 pierwiastki chemiczne tworzą kilka związków (molekularnych), frakcje masowe dowolnego z nich są powiązane jako liczby całkowite (klasa chemii 11).
W procesie oddziaływania tlenu i azotu otrzymuje się 5 tlenków. W wynurzających się cząsteczkach na 1 g azotu uwzględnia się następującą ilość tlenu w gramach: 0,57, 1,14, 1,71, 2,28, 2,85. Korelują w proporcjach: 2: 1, 1: 1, 2: 3, 1: 2, 2: 5 (kompozycje: NO, NO, N₂O₃, NO₂, N₂O₅).
Prawa Avogadro i relacje międzyludzkie
Istota tego ostatniego: w identycznych warunkach objętości reagentów gazowych odnoszą się do siebie nawzajem, a objętości otrzymanych produktów gazowych jako liczby całkowite (J. Gay-Lussac).
W przypadku oddziaływania substancji gazowych ich objętości są powiązane jako równania reakcji (stechiometryczne): 2H₂ + O₂ = 2H₂O (g).
W odniesieniu do Prawo Avogadro, następnie jego skład jest następujący: identyczne objętości gazu w tych samych warunkach zawierają taką samą liczbę moli.
Matematycznie można go przedstawić w następujący sposób:
n (x) = m: M (x), gdzie
n (x) oznacza wymaganą liczbę moli substancji,
m jest masą odpowiedniej substancji
M (x) oznacza masę molową reagenta.
Konsekwencje tego prawa:
- 1 molowa substancja gazowa zastępuje objętość 22,4 litra (w normalnych warunkach).
- 1 molowa substancja gazowa zawiera identyczną liczbę cząsteczek, która jest równa 6.023 1023 - liczba Avogadro.
- Przy znanych masach substancji gazowych lub ich masach molowych można wyznaczyć gęstość względną: mₐ: mᵦ = pₐ: pᵦ, gdzie
pₐ, pᵦ - gęstość substancji A i B, g / cm ³.
Tak więc podstawowe prawa chemii (stechiometryczne) zostały wymienione powyżej. Następny będzie traktowany jako gaz i termodynamika.
Gazowe prawa chemii
Tylko cztery prawa:
1. Boyle - Mariotta: jeśli temperatura jest wartością stałą (T = const) w procesie izotermicznym, wówczas ciśnienie wytwarzane przez masę gazu jest odwrotnie proporcjonalne do jego objętości: pV = const.
2 Gay-Lussac: jeśli ciśnienie gazu jest stałe (p = const) wewnątrz proces izobaryczny wtedy jego objętość jest wprost proporcjonalna do temperatury absolutnej: V: T = const. 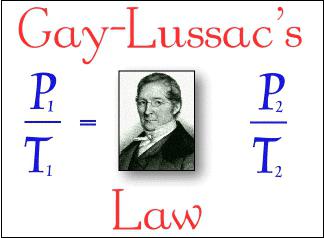
3. Charlie: jeśli objętość gazu jest stała w ramach procesu izochorycznego, to jego ciśnienie jest wprost proporcjonalne do temperatury absolutnej: P: T = const.
4. Gaz kombinowany: pV: T = const.
To są podstawowe prawa chemii gazu.
Prawa termodynamiki chemicznej
Są trzy z nich:
1. Prawo zachowania energii (chemia): jeśli w trakcie jakiegokolwiek procesu energia pierwszego rodzaju zanika, to inna forma energii "przychodzi", aby zastąpić ją w innej ilości, która jest ściśle równoważna pierwszemu. W związku z tym można powiedzieć, że w jakimkolwiek wyizolowanym systemie całkowita rezerwa energii pozostaje niezmieniona.
2. W granicach izolowanego układu procesy zachodzące spontanicznie zwiększają entropię (transformację) systemu.
3. Jeżeli temperatura ma tendencję do zera, to entropia układu pozostaje niezmieniona (niezależnie od jego parametrów).
Są to podstawowe prawa termodynamiki (chemii).
Istota prawa mas
To jest podstawowe prawo chemii fizycznej. Prawo działania mas (w chemii): szybkość, z jaką zachodzi reakcja chemiczna, jest proporcjonalna do iloczynu stężeń odczynników.
W przypadku jednorodnej reakcji z I etapem (A + B - produkty reakcji), to prawo może być przedstawione jako równanie:
v = k · cₐ · cᵦ, gdzie
v to szybkość reakcji
cₐ, cᵦ - stężenia reagentów, odpowiednio, A i B, mol / l,
k jest stałą szybkości reakcji.
Prawo działania mas (w chemii) umożliwia identyfikację fizycznego znaczenia tej stałej: jest ona równa szybkości reakcji przy stężeniach reagentów przy 1 mol / l lub wartości ich produktu równej jeden. Stała zależy od temperatury, rodzaju odczynników, ale nie od ich stężeń.
Prawo okresowe: sformułowanie, rola
Uznaje się, że prawo to jest najważniejszym osiągnięciem w chemii, można powiedzieć, podstawą współczesnej chemii. Po jego odkryciu przestała być wyłącznie nauką opisową, tak zwana foresight naukowy stał się możliwy.
Okresowe prawo (chemia) zostało odkryte przez słynnego rosyjskiego naukowca Dmitrija Iwanowicza Mendelejewa w 1869 roku. Oficjalne sformułowanie: "Właściwości ciał prostych, a także formy i właściwości związków pierwiastków są w okresowej zależności od wielkości atomowych ciężarów pierwiastków".
Są to podstawowe prawa chemii (fizyczne).
Chemia jako system wiedzy o substancjach i ich przemianach
Wiedza pochodzi z wiarygodnych, obszernych informacji na temat związków i pierwiastków (chemicznych), ich reakcji, zachowania w ramach naturalnego i sztucznego środowiska. Istniejące kryteria rzetelności badanych faktów, a także sposoby ich organizowania stale ewoluują. Główne uogólnienia są przenoszone na prawa naukowe, których sformułowanie umożliwia otwieranie nowych etapów chemii (na przykład podstawowe prawa chemii: prawo Daltona, okresowe prawo Mendelejewa itp.). Aspekty teoretyczne, w których stosowane są określone pojęcia, pozwalają wyjaśnić i przewidzieć fakty węższej dziedziny przedmiotowej. Można więc powiedzieć, że wiedza poparta doświadczeniem staje się faktem dopiero po jej teoretycznej interpretacji.
Tak więc pierwszą teorią chemiczną jest teoria "flogistonu" (jest uznawana za niepoprawną), która promuje tworzenie nowoczesnej chemii, biorąc pod uwagę fakt, że połączyła rozproszone fakty w jeden system, umożliwiając sformułowanie szeregu nowych pytań. Ale teoria strukturalna (F. Kekule, A. M. Butlerov) pomogła usprawnić i wyjaśnić rozległy materiał chemii organicznej i określić przyspieszony rozwój syntezy chemicznej, a także zbadać strukturę związków organicznych.
Nauka, o której mowa, jako wiedza, jest bardzo dynamicznym systemem. Ewolucyjny charakter procesu akumulacji wiedzy jest okresowo przerywany przez rewolucje - radykalną restrukturyzację systemu teorii, metod i faktów wraz z pojawieniem się nowego zestawu pojęć, a nawet zasadniczo nowego stylu światopoglądu i myślenia. Tak więc dzieła Antoine Laurent Lavoisier (wprowadzenie ilościowych metod eksperymentu, materialistyczna teoria utleniania, rozwój nazewnictwa chemicznego), okresowe prawo Mendelejewa, rozwój nowych metod analitycznych (chromatografia, mikroanaliza), pojawienie się nowych obszarów, które tworzą nowy przedmiot chemii i wpływające na wszystkie jego pola (na przykład chemia fizyczna, oparta na kinetyce chemicznej i termodynamice).
Warto również zauważyć, że wiedza chemiczna jest wyposażona w rozwiniętą strukturę, której szkieletem chemicznym są główne dyscypliny chemiczne powstałe w XIX wieku (chemia organiczna, analityczna, nieorganiczna i fizyczna). Następnie, w trakcie jego ewolucji, pojawiło się wiele nowych dyscyplin (chemia i chemia kryształów itp.) Oraz przemysł inżynieryjny - technologia chemiczna.
Tak więc w artykule dokonano przeglądu podstawowych pojęć i praw chemii.