Zasada Le Chateliera w chemii
W niektórych przypadkach substancje powstające w wyniku reakcji oddziałują ze sobą lub rozkładają się, a następnie w układzie występują jednocześnie dwie reakcje: bezpośrednia (powstają produkty reakcji) i odwrócona (początkowe substancje są nowo syntetyzowane). W przypadku koincydencji szybkości procesów bezpośrednich i odwrotnych w rozpatrywanym układzie występuje równowaga, która nazywana jest chemiczną. Jest to równowaga dynamiczna, ponieważ sama reakcja nie zatrzymuje się, ale tworzy się ta sama ilość substancji i rozkłada się jednocześnie. Przy stałej temperaturze i ciśnieniu sytuacja ta może utrzymywać się przez dłuższy czas. W formie graficznej przedstawiono go poniżej. Przez równoważną prędkość rozumie się pewną stałą, która jest jednocześnie równa prędkości reakcji bezpośredniej i wstecznej.
Ad
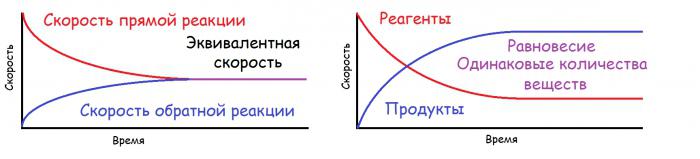
Zasada polaryzacji równowagi chemicznej
Zasada przemieszczenia (przesunięcia) równowagi została odkryta w 1884 r. Przez Le Chateliera. Później został podsumowany przez Karola Ferdinanda Browna (1887). Dlatego obecnie ma podwójne imię - zasada Le Chatelier-Brown. Prawo to stosuje się zarówno w chemii, jak iw termodynamice, elektrodynamice, ekologii i biochemii. Istnieje wiele formuł, ale istota każdego z nich sprowadza się do następującego: "Gdy wpływ wywierany jest na układ w równowadze, równowaga chemiczna zostaje przesunięta, aby skompensować tę zmianę (tj. System spróbuje przywrócić równowagę) ". Opisaną zasadę można wyraźnie wykazać za pomocą następującego systemu. Do stałego wspornika przymocowana jest sprężyna. W spoczynku ten system jest w równowadze. Jeśli sprężyna zostanie rozciągnięta, wówczas równowaga przesunie się w kierunku zewnętrznego wpływu. Jednak system również zwiększa opozycję. I w pewnym momencie siły opozycji i wpływ zewnętrzny stają się sobie równe, w wyniku czego pojawia się nowy stan równowagi.
Ad
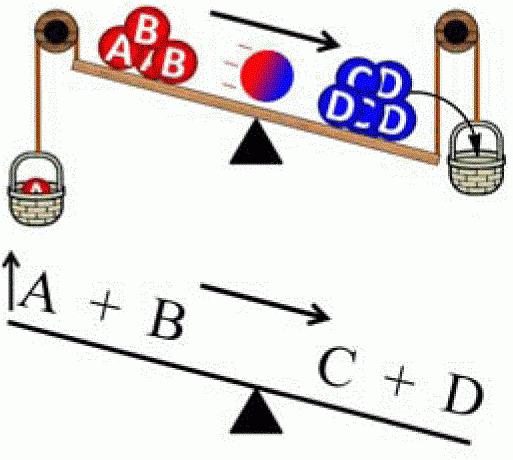
Zasada działania Le Chateliera może być stosowana tylko w systemach w stanie równowagi, w przeciwnym razie wyniki analizy będą nieprawidłowe. Istnieją trzy główne parametry, których zmiana powoduje przesunięcie równowagi chemicznej: ciśnienie, temperaturę i stężenie substancji chemicznych.
Temperatura
Zmiana temperatury jest najczęstszą przyczyną zmiany równowagi chemicznej, co jest zrozumiałe, ponieważ ten czynnik jest znacznie łatwiejszy do wpływania niż na przykład ciśnienie. Należy tu wspomnieć, że reakcje są podzielone na dwa typy poprzez efekt cieplny. Należą do nich: egzotermiczny (z ciepłem) i endotermiczny (z jego absorpcją). Jak zmieni się w tym przypadku równowaga chemiczna? Zasada Le Chateliera w tym przypadku sprowadza się do następujących: wraz ze wzrostem temperatury, równowaga przesuwa się w kierunku reakcji, która zachodzi wraz z pochłanianą temperaturą, i gdy zmniejsza się odpowiednio w przeciwnym kierunku. Tak więc, jeśli reakcja przedstawiona poniżej podniesie temperaturę, waga przesunie się na prawą stronę.
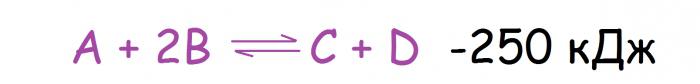
Większość reakcji bezpośrednich jest egzotermiczna, a reakcje odwrotne są endotermiczne (nie jest to reguła, ale raczej obserwacja, z której można znaleźć wiele wyjątków).
Ciśnienie
Wraz ze zmianą ciśnienia następuje transformacja następnego parametru układu - jego objętości (wzrasta lub maleje), dlatego efekt zastosowania tego parametru ma szczególnie silny wpływ na układy, w których obecne są gazy. W tym przypadku zasada równowaga chemiczna jest następujący. Jeśli ciśnienie w układzie wzrasta, wówczas równowaga przesuwa się w kierunku zmniejszania liczby cząsteczek gazu, a gdy ciśnienie spada, równowaga przemieszcza się w przeciwnym kierunku. Jeśli liczba cząsteczek gazu nie zmienia się podczas reakcji, wówczas równowaga nie zmienia się wraz ze zmianą ciśnienia, jak na przykład w następnej reakcji.
Ad
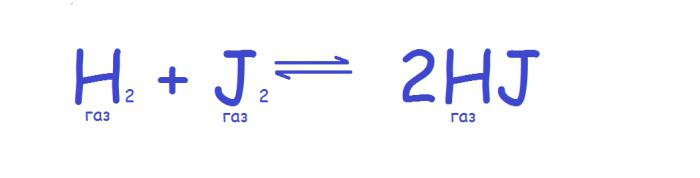
Jednak w praktyce zasada ta dotyczy wyłącznie gazów idealnych, ponieważ wszystkie rzeczywiste mają różną ściśliwość. Tak więc, nawet jeśli liczba cząsteczek gazu pozostaje niezmieniona, równowaga może zależeć od ciśnienia. W praktyce będzie to zauważalne, kiedy wysokie ciśnienia. W przypadku substancji ciekłych i stałych zmiana ciśnienia w rzeczywistości nie wpływa na równowagę ze względu na małe objętości zajmowane przez takie substancje. Rozważając systemy mieszane, brane są pod uwagę tylko cząsteczki gazu.
Przesunięcie równowagi w układzie w wyniku zmian stężenia dowolnej substancji biorącej udział w reakcji
W trakcie zmiany stężenia substancji zasada Le Chateliera działa w następujący sposób. Wraz ze wzrostem stężenia produktów reakcji, równowaga przesuwa się w kierunku reakcji odwrotnej, a wraz ze zmniejszeniem ilości utworzonych substancji, równowaga przemieszcza się w przeciwnym kierunku.
Ad
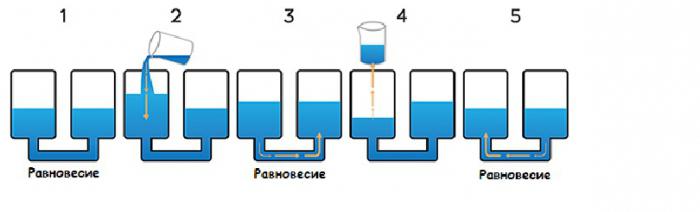
Co się stanie, jeśli dodasz gaz obojętny
Możesz zmienić objętość systemu nie tylko poprzez jego ściśnięcie lub osłabienie ciśnienia, ale także przez dodanie gazu obojętnego, który nie reaguje. Co stanie się z systemem, gdy zostanie do niego dodany hel? W rzeczywistości najprawdopodobniej nic się nie wydarzy, ponieważ stosunek substancji biorących udział w reakcji nie zmieni się, a proces nie ma znaczenia całkowite ciśnienie układu, ale częściowe każdego składnika.
Efekt katalizatorów
Ilość katalizatora i jego obecność w ogólności nie mają żadnego wpływu na przesunięcie równowagi chemicznej. Dzieje się tak z uwagi na to, że element ten przyspiesza zarówno reakcję bezpośrednią, jak i odwrotną, utrzymując równowagę w systemie bez zmian.
Sposób badania równowagi chemicznej
Szczegółowe rozważenie równowagi chemicznej jest bardzo ważne dla pełnego zrozumienia procesu. Jedną z najczęściej stosowanych technik jest tak zwana metoda zamrażania równowagowego. Jest szybki post układ chłodzenia w stanie równowagi. Równowaga po prostu nie ma czasu na zmianę, aw niskich temperaturach prędkość większości procesów zwalnia do niemal zera. Dzięki temu możliwe jest całkowite przeanalizowanie składu mieszaniny w dowolnej temperaturze (stężenie substancji biorących udział w reakcji, przy zerowych stopniach, będzie odpowiadało liczbie składników w temperaturze, w której rozpoczęło się zmniejszenie). Doświadczenie to przeprowadza się kilkakrotnie z reakcjami przebiegającymi w obu kierunkach.
Ad
Czy istnieje całkowita nieodwracalność?
Niemożliwe jest całkowite przesunięcie równowagi chemicznej w jednym kierunku. Nawet przy pozornym bezwzględnym przemieszczeniu zawsze będzie mała liczba cząsteczek, które będą reagować.

W praktyce praktycznie wszystkie reakcje są odwracalne i jak bardzo ten efekt będzie widoczny, często zależy od temperatury (często równowaga jest po prostu mocno przesunięta w jednym kierunku, więc staje się zauważalna tylko wtedy, gdy zmieniają się warunki). To z powodu tej przewagi odwracalnej reakcje chemiczne badanie równowagi jest szczególnie ważne.
Przykłady syntezy, w których równowaga chemiczna zmienia się podczas produkcji
W produkcji równowaga chemiczna zwykle przesuwa się w kierunku reakcji bezpośredniej, aby otrzymać odpowiednio produkty reakcji. Istnieje wiele przykładów takich syntez: uzyskiwanie amoniaku tlenek siarki (VI), tlenek azotu (II) itp.