Skład i struktura jądra atomowego (krótko)
Na długo przed pojawieniem się wiarygodnych danych na temat wewnętrznej struktury wszystkiego, co istnieje, greccy myśliciele wyobrażali sobie materię w postaci najmniejszych ognistych cząstek, które były w ciągłym ruchu. Prawdopodobnie ta wizja światowego porządku rzeczy wywodzi się z czysto logicznych konkluzji. Pomimo pewnej naiwności i absolutnej niesubstancjalności tego stwierdzenia, okazało się to prawdą. Chociaż naukowcy mogli potwierdzić odważne domysły zaledwie dwadzieścia trzy wieki później.
Struktura atomowa
Pod koniec XIX wieku zbadano właściwości rury wyładowczej, przez którą przepływa prąd. Obserwacje wykazały, że w tym przypadku emitowane są dwa strumienie cząstek:
- Promienie katodowe, które tworzą się w pobliżu elektrod połączonych z ujemnym końcem baterii. Promienie katod przechodzą przez rurę i mogą prześlizgnąć się przez otwór w elektrodzie dodatniej, jak strumień naładowanych cząstek. Obserwacje wykazały, że stosunek ładunku takiej cząstki do jej masy jest zawsze taki sam i nie zależy od rodzaju gazu.
- Promienie pozytywne. Drugi strumień cząsteczek idzie w przeciwnym kierunku i może przejść do otworu w elektrodzie ujemnej. Odchylenia w polach dowodzą, że mają one wysokie prędkości i różne wartości stosunku ładunku do masy.
Ujemne cząstki promieni katodowych nazywano elektronami. Następnie w wielu procesach znaleziono cząstki o tym samym stosunku ładunku do masy. Elektrony zdawały się być uniwersalnymi składnikami różnych atomów, dość łatwo oddzielającymi się podczas bombardowania jonów i atomów.
Cząstki przenoszące ładunek dodatni wydawały się być fragmentami atomów po utracie jednego lub więcej elektronów. W rzeczywistości pozytywne promienie były grupami atomów pozbawionymi ujemnych cząstek, a w rezultacie miały dodatni ładunek.
Ad
Model Thompsona
W oparciu o eksperymenty stwierdzono, że cząstki dodatnie i ujemne reprezentowały istotę atomu, były jego składowymi. Angielski naukowiec J. Thomson zaproponował swoją teorię. Jego zdaniem struktura atomu i jądra atomowego była rodzajem masy, w której ładunki ujemne zostały ściśnięte do dodatnio naładowanej kuli, jak rodzynki w cieście. Kompensacja ładunku spowodowała, że "ciastko" było elektrycznie obojętne. 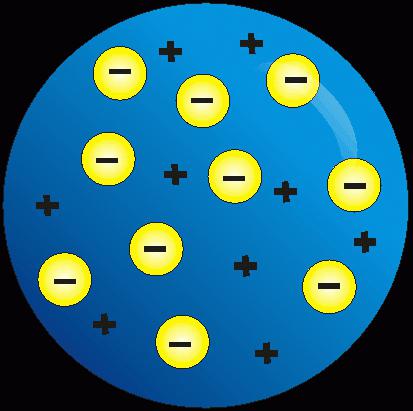
Model Rutherforda
Młody amerykański naukowiec Rutherford, analizując ślady pozostawione po cząstkach alfa, doszedł do wniosku, że model Thompsona jest niedoskonały. Niektóre cząstki alfa były odchylane pod niewielkimi kątami - 5-10 o . W rzadkich przypadkach cząstki alfa odchyliły się pod dużymi kątami 60-80 o , aw wyjątkowych przypadkach kąty były bardzo duże - 120-150 o . Model atomu Thompsona nie mógł wyjaśnić takiej różnicy.
Ad
Rutherford proponuje nowy model wyjaśniający strukturę atomu i jądra atomowego. Fizyka procesów twierdzi, że atom musi być w 99% pusty, z maleńkim jądrem i elektronami obracającymi się wokół niego, które poruszają się po orbitach. 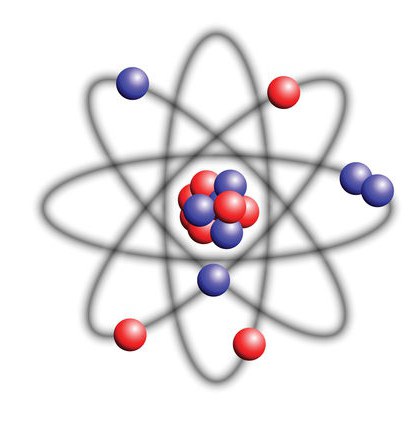
Odchylenia w uderzeniach, wyjaśnia fakt, że cząsteczki atomu mają swoje własne ładunki elektryczne. Pod wpływem bombardowania naładowanych cząstek elementy atomowe zachowują się jak zwykłe naładowane ciała w makrokosmosie: cząsteczki z identycznymi ładunkami odpychają się nawzajem, a przeciwne ładunki przyciągają się nawzajem.
Stan atomów
Na początku ubiegłego wieku, kiedy uruchomiono pierwsze akceleratory cząstek elementarnych, wszystkie teorie, które wyjaśniały strukturę jądra atomowego i samego atomu, czekały na eksperymentalną weryfikację. Do tego czasu dokładnie zbadano interakcje promieni alfa i beta z atomami. Do 1917 r. Uważano, że atomy są stabilne lub radioaktywne. Stabilne atomy nie mogą zostać rozdzielone, nie można kontrolować rozpadu radioaktywnych jąder. Ale Rutherford zdołał obalić tę opinię.
Ad
Pierwszy proton
W 1911 r. E. Rutherford wysunął hipotezę, że wszystkie jądra składają się z identycznych pierwiastków, których podstawą jest atom wodoru. Na tę myśl naukowiec pchnął ważny wniosek z poprzednich badań nad strukturą materii: masy wszystkich pierwiastków chemicznych są podzielone bez pozostałości przez masę wodoru. Nowe założenie otworzyło niespotykane dotąd możliwości, pozwalając na nowe spojrzenie na strukturę jądra atomowego. Reakcje jądrowe powinny potwierdzić lub obalić nową hipotezę.
Eksperymenty przeprowadzono w 1919 roku z atomami azotu. Bombardując je cząstkami alfa, Rutherford osiągnął zaskakujący wynik.
Atom N wchłonął cząstkę alfa, a następnie zamienił się w atom tlenu O 17 i wyemitował jądro wodoru. Była to pierwsza sztuczna transformacja atomu jednego elementu w drugi. Takie doświadczenie wzbudziło nadzieję, że struktura jądra atomowego, fizyka istniejących procesów pozwala na inne przekształcenia jądrowe.
Ad

Naukowiec wykorzystał w swoich eksperymentach metodę scyntylacji - flash. Z częstotliwości wybuchów wyciągnął wnioski o tym, czym jest skład i struktura jądra atomowego, o charakterystyce wytwarzanych cząstek, o ich masie atomowej i liczbie sekwencji. Nieznaną cząstkę nazwano protonem Rutherforda. Miał wszystkie cechy atomu wodoru, pozbawionego jedynego elektronu - pojedynczego ładunku dodatniego i odpowiadającej mu masy. W ten sposób udowodniono, że proton i jądro wodoru są tymi samymi cząsteczkami.
W 1930 roku, kiedy zbudowano i uruchomiono pierwsze duże akceleratory, przetestowano i udowodniono model atomowy Rutherforda: każdy atom wodoru składa się z pojedynczego elektronu, którego położenie jest niemożliwe do określenia, oraz z luźnego atomu z pojedynczym dodatnim protonem wewnątrz. Ponieważ protony, elektrony i cząsteczki alfa mogą latać od atomu, gdy są bombardowane, naukowcy uważali, że są one składnikami dowolnego jądra atomowego. Ale taki model jądra atomowego wydawał się niestabilny - elektrony były zbyt duże, aby zmieściły się w jądrze, ponadto istniały poważne trudności związane z naruszeniem prawa pędu i zachowania energii. Te dwa prawa, jako surowi księgowi, stwierdzili, że ilość ruchu i masy podczas bombardowania znika w nieznanym kierunku. Ponieważ przepisy te zostały ogólnie przyjęte, konieczne było znalezienie wyjaśnień takiego wycieku.
Ad
Neutrony
Naukowcy z całego świata rozpoczęli eksperymenty mające na celu odkrycie nowych składników jąder atomowych. W latach trzydziestych niemieccy fizycy Becker i Bothe bombardowali atomy berylu cząsteczkami alfa. W tym przypadku zarejestrowano nieznane promieniowanie, które zostało nazwane G-promieniowaniem. Szczegółowe badania opisują niektóre cechy nowych promieni: mogą rozprzestrzeniać się ściśle w linii prostej, nie wchodzą w interakcje z polami elektrycznymi i magnetycznymi i mają dużą moc przenikania. Później cząstki tworzące ten rodzaj promieniowania znaleziono w interakcji cząstek alfa z innymi pierwiastkami - borem, chromem i innymi.
Hipoteza Chadwicka
Następnie James Chadwick, kolega i uczeń Rutherforda, w magazynie "Nature" udzielił krótkiej wiadomości, która później stała się znana. Chadwick zwrócił uwagę na to, że sprzeczności w prawach zachowania są łatwe do rozwiązania, zakładając, że nowe promieniowanie jest strumieniem neutralnych cząstek, z których każda ma masę w przybliżeniu równą masie protonu. Biorąc pod uwagę to założenie, fizycy zasadniczo uzupełnili hipotezę wyjaśniającą strukturę jądra atomowego. Krótko mówiąc, istota dodatków została zredukowana do nowej cząstki i jej roli w strukturze atomu. 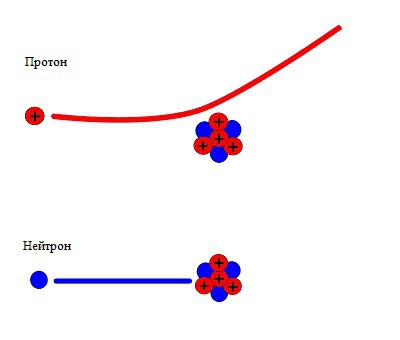
Właściwości neutronów
Wykryta cząsteczka otrzymała nazwę "neutron". Nowo odkryte cząstki nie tworzyły pól elektromagnetycznych wokół siebie, łatwo przechodziły przez substancję bez utraty energii. W rzadkich zderzeniach z lekkimi jądrami atomów neutron jest w stanie wybić jądro z atomu, tracąc znaczną część swojej energii. Struktura jądra atomowego zakładała obecność różnej liczby neutronów w każdej substancji. Atomy o tym samym ładunku jądrowym, ale o różnej liczbie neutronów nazywane są izotopami.
Neutrony służyły jako doskonały zamiennik cząstek alfa. Obecnie są wykorzystywane do badania struktury jądra atomowego. Krótko mówiąc, nie można opisać ich znaczenia dla nauki, ale właśnie dzięki bombardowaniu jądra atomowego neutronami fizycy byli w stanie uzyskać izotopy niemal wszystkich znanych pierwiastków.
Skład jądra atomu
Obecnie struktura jądra atomowego jest kombinacją protonów i neutronów utrzymywanych razem przez siły jądrowe. Na przykład jądro helu jest wiązką dwóch neutronów i dwóch protonów. Lekkie pierwiastki mają prawie taką samą liczbę protonów i neutronów, podczas gdy ciężkie pierwiastki mają znacznie większą liczbę neutronów. 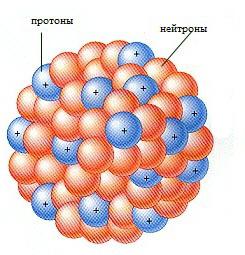 Ten obraz struktury jądra potwierdzają eksperymenty na nowoczesnych dużych akceleratorach z szybkimi protonami. Siły elektryczne odpychania protonów są równoważone przez siły jądra, które działają tylko w samym rdzeniu. Chociaż natura siły jądrowe jeszcze nie w pełni zrozumiane, ich istnienie jest prawie udowodnione iw pełni wyjaśnia strukturę jądra atomowego.
Ten obraz struktury jądra potwierdzają eksperymenty na nowoczesnych dużych akceleratorach z szybkimi protonami. Siły elektryczne odpychania protonów są równoważone przez siły jądra, które działają tylko w samym rdzeniu. Chociaż natura siły jądrowe jeszcze nie w pełni zrozumiane, ich istnienie jest prawie udowodnione iw pełni wyjaśnia strukturę jądra atomowego.
Związek masy i energii
W 1932 roku kamera Wilsona zrobiła zdumiewającą fotografię potwierdzającą istnienie dodatnich naładowanych cząstek masa elektronowa. Przed tym, teoretycznie przewidywane były elektrony dodatnie P. Diraca. Prawdziwy pozytywny elektron wykryto również w promieniowaniu kosmicznym. Nowy utwór nazwano pozytonem. Kiedy zderzasz się z jego bliźniakiem - elektronem, następuje anihilacja - wzajemne zniszczenie dwóch cząstek. To uwalnia pewną ilość energii.
Przed tym, teoretycznie przewidywane były elektrony dodatnie P. Diraca. Prawdziwy pozytywny elektron wykryto również w promieniowaniu kosmicznym. Nowy utwór nazwano pozytonem. Kiedy zderzasz się z jego bliźniakiem - elektronem, następuje anihilacja - wzajemne zniszczenie dwóch cząstek. To uwalnia pewną ilość energii.
Tak więc teoria opracowana dla makro-świata była w pełni odpowiednia do opisu zachowania najmniejszych elementów materii.