Izotopy wodoru: właściwości, charakterystyka i zastosowanie
Każdy pierwiastek chemiczny ma różne naturalne lub sztuczne pochodzenie, zwane izotopami. Różnica między nimi polega na nierównomiernej liczbie neutronów w jądrach, a tym samym na masie atomowej, a także stopniu stabilności. Jeśli chodzi o liczbę protonów, to jest to to samo, dzięki czemu element w rzeczywistości pozostaje sam. W tym artykule zwracamy się do izotopów wodoru - najlżejszego i najbardziej powszechnego elementu we wszechświecie. Musimy rozważyć ich właściwości, ich rolę w przyrodzie i obszar praktycznego zastosowania.
Ile jest gatunków wodoru?
Odpowiedź na to pytanie zależy od tego, co oznaczają izotopy wodoru.
Dla tego pierwiastka stworzono trzy naturalne formy izotopowe: prot - lekki wodór, ciężki deuter i super-ciężki tryt. Wszystkie znajdują się w ich naturalnej formie.
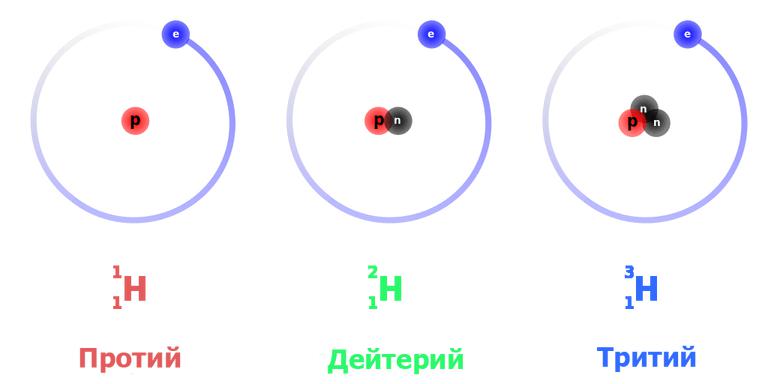
Oprócz nich istnieją cztery sztucznie syntetyzowane izotopy: quad, pentium, heks i septia. Gatunki te charakteryzują się ekstremalną niestabilnością, czas życia ich jąder jest wyrażany wartościami rzędu 10 -22 - 10-23 sekundy.
Tak więc, dzisiaj, siedem gatunków izotopowych jest znanych z wodoru. Skupimy naszą uwagę na trzech z nich o praktycznym znaczeniu.
Lekki wodór
To najprostszy atom. Izotop wodoru izotopu o masie atomowej 1,0078a. E. m. Ma jądro, które składa się tylko z jednej cząstki - protonu. Ponieważ jest stabilny (teoretycznie szacuje się, że czas życia protonu jest nie mniejszy niż 2,9 × 10 29 lat), atom protu jest również stabilny. Podczas rejestrowania reakcji jądrowych jest oznaczony jako 1 H 1 (dolny jest liczbą atomową, to znaczy liczbą protonów, górna jest całkowitą liczbą nukleonów w jądrze), czasami po prostu p - "proton".
Ad
Izotop lekki stanowi prawie 99,99% wodoru; tylko nieco więcej niż setny procent odpowiada za inne formy. To właśnie Protium ma decydujący wpływ na powszechność występowania wodoru w przyrodzie: we wszechświecie jako całości, około 75% masy materii barionowej i około 90% atomów; na Ziemi - 1% masy i aż 17% atomów wszystkich pierwiastków tworzących naszą planetę. Na ogół protium (a dokładniej proton jako jeden z głównych składników Wszechświata) można bezpiecznie określić jako najważniejszy element. Daje możliwość termojądrowej fuzji w głębinach gwiazd, w tym Słońca, i dzięki temu powstają inne elementy. Ponadto, lekki wodór odgrywa ważną rolę w budowaniu i funkcjonowaniu żywa materia.
Ad

W postaci cząsteczkowej wodór wchodzi w interakcje chemiczne w wysokich temperaturach, ponieważ rozszczepienie wystarczająco silnej cząsteczki wymaga dużej ilości energii. Atomowy wodór charakteryzuje się bardzo wysoką aktywnością chemiczną.
Deuter
Ciężki izotop wodoru ma bardziej złożone jądro składające się z protonu i neutronu. Odpowiednio masa atomowa deuteru jest dwa razy większa - 2,0141. Akceptowane oznaczenie to 2 H 1 lub D. Ta forma izotopowa jest również stabilna, ponieważ w procesach silnej interakcji w jądrze proton i neutron ciągle się nawzajem się nawracają, a ten drugi nie ma czasu na zanikanie.
Na Ziemi wodór zawiera od 0,011% do 0,016% deuteru. Jego stężenie jest różne w zależności od środowiska: w wodzie morskiej tego izotopu jest większa, aw składzie, na przykład, gazu ziemnego - znacznie mniej. Na innych ciałach Układu Słonecznego stosunek deuteru do światła wodoru może być różny: na przykład lód niektórych komet zawiera większą ilość ciężkiego izotopu.
Ad
Deuter topi się przy 18,6 K (lekki wodór przy 14 K) i wrze w temperaturze 23,6 K (odpowiadający punkt protu wynosi 20,3 K). Ciężki wodór wykazuje na ogół takie same właściwości chemiczne jak prot, tworząc wszystkie charakterystyczne typy związków dla tego pierwiastka, ale pewne cechy związane z poważną różnicą w masie atomowej są mu nieodłączne, ponieważ deuter jest 2 razy cięższy. Należy zauważyć, że z tego powodu formy izotopowe wodoru charakteryzują się największymi różnicami chemicznymi spośród wszystkich pierwiastków. Ogólnie rzecz biorąc, niższe szybkości (5-10 razy) reakcji są charakterystyczne dla deuteru.
Rola deuteru w przyrodzie
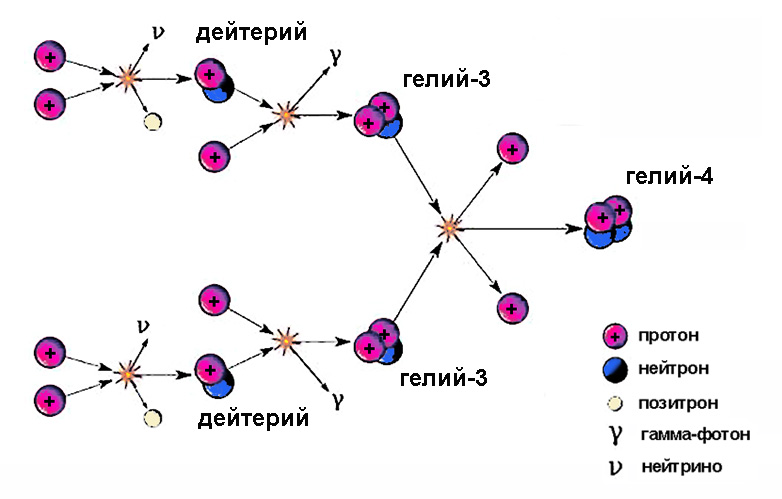
Jądra ciężkiego wodoru biorą udział w pośrednich etapach cyklu termojądrowego. Słońce świeci dzięki temu procesowi, w jednym z etapów, w którym powstały izotop wodoru, połączony z protonem, powoduje powstanie helu-3.
Woda, która zawiera, oprócz protu, jeden atom deuteru, nazywana jest lekkim ciężarem i ma formułę HDO. W ciężkiej cząsteczce wody D 2 O, deuter całkowicie zastępuje lekki wodór.
Ciężka woda charakteryzuje się powolnym przebiegiem reakcji chemicznych, w wyniku czego w wysokich stężeniach jest szkodliwy dla organizmów żywych, zwłaszcza wyższych, takich jak ssaki, w tym ludzie. Jeśli w wodzie znajduje się jedna czwarta wodoru zastąpionego przez deuter, jego przedłużone stosowanie jest obarczone rozwojem niepłodności, niedokrwistością i innymi chorobami. Podczas zastępowania 50% wodoru, ssaki umierają po tygodniu spożywania takiej wody. Jeśli chodzi o krótkoterminowe wzrosty stężenia ciężkiego wodoru w wodzie, jest to praktycznie nieszkodliwe.
Ad

Jak zdobyć ciężki wodór
Najwygodniejszy sposób na uzyskanie tego izotopu w składzie wody. Istnieje kilka sposobów wzbogacania wody w deuter:
- Rektyfikacja to proces rozdzielania mieszanin na składniki wrzące w różnych temperaturach. Rozdzielanie osiąga się poprzez wielokrotne odparowanie i kondensację mieszaniny izotopów w ciekłym wodorze lub wodzie na specjalnych urządzeniach - kolumnach destylacyjnych, w których fazy gazowe i ciekłe przepływają w przeciwnych kierunkach.
- Rozdzielanie elektrolityczne. Metoda opiera się na tym, że elektroliza wody izotop lekki jest aktywniej odszczepiany od jego cząsteczek. Elektrolizę przeprowadza się w kilku etapach.
- Wymiana izotopów jonów, w których następuje wzajemna wymiana jonów różnych izotopów w składzie odczynników. Obecnie ta metoda z użyciem wody i siarkowodoru jako reagentów jest najbardziej efektywna i ekonomiczna.

Tryt
Super-ciężki izotop wodoru, w którego rdzeniu występuje proton i dwa neutrony, ma masę atomową 3,016 - około trzy razy więcej niż atom protu. Tryt oznaczany jest symbolem T lub 3 H 1 . Topi się i wrze w jeszcze wyższych temperaturach: 20,6 K i 25 K, odpowiednio.
Jest radioaktywnym niestabilnym izotopem o okresie półtrwania równym 12,32 lat. Powstaje podczas bombardowania jąder gazów atmosferycznych, na przykład azotu, cząstek promieni kosmicznych. Rozpad izotopu występuje wraz z emisją elektronu (tzw. Rozpadu beta), podczas gdy jeden neutron w jądrze ulega przekształceniu w proton, a pierwiastek chemiczny podnosi liczbę atomową o jeden, stając się helem-3. W naturze tryt występuje w śladowych ilościach - jest bardzo mały.
Ad
Super-ciężki wodór powstaje w reaktorach jądrowych ciężkiej wody, gdy deuter jest wychwytywany przez wolne (termiczne) neutrony. Część z nich jest dostępna do ekstrakcji i służy jako źródło trytu. Ponadto otrzymuje się go jako produkt rozpadu litu, gdy jest napromieniowywany neutronami termicznymi.
Tryt charakteryzuje się niską energią zaniku i stwarza pewne zagrożenie radiacyjne tylko wtedy, gdy wchodzi do ciała z powietrzem lub pożywieniem. Gumowe rękawice wystarczą, aby ochronić skórę przed promieniowaniem beta.
Zastosowanie izotopów wodoru
Lekki wodór jest stosowany w wielu gałęziach przemysłu: w przemyśle chemicznym, gdzie jest używany do produkcji amoniaku, metanolu, kwasu solnego i innych substancji, w rafinacji ropy naftowej i metalurgii, gdzie jest potrzebny do odzyskiwania metali ogniotrwałych z tlenków. Jest również stosowany na niektórych etapach cyklu produkcyjnego (w produkcji tłuszczów stałych) w przemyśle spożywczym i kosmetycznym. Wodór jest jednym z rodzajów paliwa rakietowego i jest stosowany w praktyce laboratoryjnej w nauce i przemyśle.
Deuter jest niezbędny w energetyce jądrowej jako doskonały moderator neutronów. Jest on wykorzystywany w tym charakterze, a także jako chłodziwo w ciężkich reaktorach wodnych, umożliwiając wykorzystanie naturalnego uranu, co zmniejsza koszt wzbogacenia. On, razem z trytem, jest składnikiem działającej mieszaniny w broni termojądrowej.

Chemiczne właściwości ciężkiego wodoru umożliwiają zastosowanie go w produkcji preparatów medycznych w celu spowolnienia ich eliminacji z organizmu. I wreszcie, deuter (jak tryt) ma perspektywy dla jakości paliwa w energii termojądrowej.
Widzimy więc, że wszystkie izotopy wodoru są w jakiś sposób "w biznesie" zarówno w ujęciu tradycyjnym, jak i zaawansowanym technologicznie, z myślą o przyszłości gałęzi technologii, technologii i badań naukowych.