Kwas siarkowy i jego właściwości chemiczne
Kwasy to związki chemiczne składające się z atomów wodoru i reszt kwasowych, np. SO4, SO3, PO4 itd. Są nieorganiczne i organiczne. Pierwsze obejmują kwas solny, fosforowy, siarczkowy, azotowy, siarkowy. Do drugiego - kwas octowy, palmitynowy, mrówkowy, stearynowy itp.
Co to jest kwas siarkowy
Kwas ten składa się z dwóch atomów wodoru i reszty kwasowej SO4. Ma wzór H2SO4. 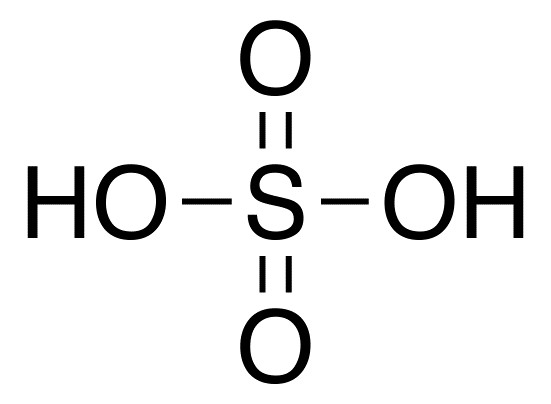 Kwas siarkowy lub, jak to się nazywa, siarczan, odnosi się do nieorganicznych kwasów dwuzasadowych zawierających tlen. Substancja ta jest uważana za jedną z najbardziej agresywnych i aktywnych chemicznie. W większości reakcji chemicznych działa jako środek utleniający. Kwas ten można stosować w postaci stężonej lub rozcieńczonej, w tych dwóch przypadkach ma on nieco inne właściwości chemiczne.
Kwas siarkowy lub, jak to się nazywa, siarczan, odnosi się do nieorganicznych kwasów dwuzasadowych zawierających tlen. Substancja ta jest uważana za jedną z najbardziej agresywnych i aktywnych chemicznie. W większości reakcji chemicznych działa jako środek utleniający. Kwas ten można stosować w postaci stężonej lub rozcieńczonej, w tych dwóch przypadkach ma on nieco inne właściwości chemiczne.
Właściwości fizyczne
Kwas siarkowy w normalnych warunkach ma stan ciekły, jego temperatura wrzenia wynosi około 279,6 stopni Celsjusza, temperatura zamarzania, gdy przechodzi w kryształy stałe, wynosi około -10 stopni za sto procent i około 20 za 95 procent.  Czystym stuprocentowym kwasem siarczanowym jest oleista, bezwonna i bezbarwna ciecz, która ma prawie dwukrotnie większą gęstość niż woda - 1 840 kg / m3.
Czystym stuprocentowym kwasem siarczanowym jest oleista, bezwonna i bezbarwna ciecz, która ma prawie dwukrotnie większą gęstość niż woda - 1 840 kg / m3.
Właściwości chemiczne kwasu siarczanowego
Kwas siarkowy reaguje z metalami, ich tlenkami, wodorotlenkami i solami. Rozcieńczony wodą w różnych proporcjach, może zachowywać się inaczej, dlatego bardziej szczegółowo rozważamy właściwości stężonego i słabego roztworu kwasu siarkowego.
Skoncentrowany roztwór kwasu siarkowego
Skoncentrowany jest roztwór zawierający 90% kwasu siarczanowego. Taki roztwór kwasu siarkowego może reagować nawet z niskocząsteczkowymi metalami, a także z niemetalami, wodorotlenkami, tlenkami, solami. Właściwości takiego roztworu kwasu siarczanowego są podobne do właściwości stężonego kwasu azotowego. 
Interakcja z metalami
Gdy reakcja chemiczna stężonego roztworu kwasu siarczanowego z metalami znajdującymi się po prawej stronie wodoru w elektrochemicznych szeregach naprężeń metalicznych (to znaczy, że nie są one najbardziej aktywne), powstają takie substancje: siarczan metalu, z którym zachodzi oddziaływanie, woda i dwutlenek siarki. Miedź (cuprum), rtęć, bizmut, srebro (argentum), platyna i złoto (aurum) to metale, które są wynikiem interakcji, z którymi tworzą się wymienione substancje.

Interakcja z nieczynnymi metalami
W przypadku metali znajdujących się po lewej stronie wodoru w szeregu naprężeń, stężony kwas siarkowy zachowuje się nieco inaczej. W wyniku takiej reakcji chemicznej powstają następujące substancje: określony siarczan metalu, siarkowodór lub czysta siarka i woda. Żelazo (ferum), magnez, mangan, beryl, lit, bar, wapń i wszystkie pozostałe w szeregu naprężeń po lewej stronie wodoru, z wyjątkiem aluminium, chromu, niklu i tytanu - są również zagęszczone metalami; kwas siarczanowy nie reaguje.
Interakcja z niemetalami
Substancja ta jest silnym utleniaczem, dlatego może brać udział w reakcjach chemicznych redoks z niemetalami, takimi jak na przykład węgiel (węgiel) i siarka. W wyniku takich reakcji woda jest koniecznie uwalniana. Dodanie tej substancji do węgla uwalnia również dwutlenek węgla i dwutlenek siarki. A jeśli dodasz kwas do siarki, otrzymamy tylko dwutlenek siarki i wodę. W takiej reakcji chemicznej kwas siarczanowy pełni rolę czynnika utleniającego.
Interakcje z substancjami organicznymi
Wśród reakcji kwasu siarkowego z materia organiczna można odróżnić zwęglenia. Taki proces zachodzi, gdy dana substancja koliduje z papierem, cukrem, włóknami, drewnem itp. W każdym razie węgiel uwalnia się. Węgiel, który powstał podczas reakcji, może częściowo oddziaływać z kwasem siarkowym, gdy jest w nadmiarze. Zdjęcie pokazuje reakcję cukru z roztworem kwasu siarczanowego o średnim stężeniu.

Reakcje z solami
Stężony roztwór H2SO4 reaguje również z suchymi solami. W tym przypadku zachodzi standardowa reakcja wymiany, w której powstaje siarczan metalu, który jest obecny w strukturze soli, i kwas z resztą, która była w kompozycji soli. Jednak w przypadku roztworów soli stężony kwas siarkowy nie reaguje.
Interakcje z innymi substancjami
Również ta substancja może reagować z tlenkami metali i ich wodorotlenkami, w tych przypadkach zachodzą reakcje wymiany, w pierwszym z nich siarczan metalu i woda są uwalniane, w drugim - to samo.
Właściwości chemiczne słabego roztworu kwasu siarczanowego
Rozcieńczony kwas siarkowy reaguje z wieloma substancjami i ma takie same właściwości jak wszystkie kwasy. W odróżnieniu od skoncentrowanego oddziałuje tylko z aktywnymi metalami, czyli tymi, które znajdują się na lewo od wodoru w szeregu naprężeń. W takim przypadku zachodzi ta sama reakcja podstawienia, jak w przypadku dowolnego kwasu. To uwalnia wodór. Również taki roztwór kwasu oddziałuje z roztworami soli, w wyniku czego zachodzi reakcja wymiany, którą już omówiono powyżej, z tlenkami - a także stężonymi, z wodorotlenkami - również w ten sam sposób. Oprócz zwykłych siarczanów istnieją także wodorosiarczany, które są produktem oddziaływania wodorotlenku i kwasu siarkowego.

Jak się dowiedzieć, czy roztwór zawiera kwas siarkowy lub siarczany
Aby określić, czy te substancje są obecne w roztworze, specjalne jakość reakcji do jonów siarczanowych, co pozwala wiedzieć. Polega na dodaniu do roztworu baru lub jego związków. W rezultacie może wypaść biały osad. (siarczan baru), co wskazuje na obecność siarczanów lub kwasu siarkowego.
Jak wydobywać kwas siarkowy
Najpowszechniejszą metodą przemysłowej produkcji tej substancji jest jej ekstrakcja z pirytu żelaza. Proces ten przebiega w trzech etapach, przy których każdorazowo zachodzi określona reakcja chemiczna. Rozważ je. Najpierw do pirytu dodaje się tlen, w wyniku czego powstaje tlenek żelaza i dwutlenek siarki, który jest używany do dalszych reakcji. Ta interakcja występuje w wysokich temperaturach. Następnie następuje etap, w którym otrzymuje się trójtlenek siarki przez dodanie tlenu w obecności katalizatora, którym jest tlenek wanadu. Teraz, w ostatnim etapie, do otrzymanej substancji dodaje się wodę i otrzymuje się kwasy siarczanowe. Jest to najczęstszy proces produkcji komercyjnej kwasu siarczanowego, jest on najczęściej stosowany, ponieważ piryt jest najłatwiej dostępnym surowcem odpowiednim do syntezy substancji opisanej w tym artykule. Kwas siarkowy otrzymany w tym procesie stosuje się w różnych gałęziach przemysłu, zarówno chemicznych, jak i wielu innych, na przykład rafinacja oleju wzbogacanie rud itp. Również jego stosowanie jest często przewidziane w technologii wytwarzania zestawu włókien syntetycznych.