Pierwsza zasada termodynamiki jest wyjaśnieniem tego prawa i praktycznych przykładów.
Procesy fizyczne, takie jak ciepło i praca, można wytłumaczyć prostym transferem energii z jednego ciała do drugiego. W przypadku pracy chodzi o to energia mechaniczna Ciepło przyjmuje energię cieplną. Przenoszenie energii odbywa się zgodnie z zasadami termodynamiki. Główne punkty tej części fizyki znane są jako "początki".
Pierwsza zasada termodynamiki reguluje i ogranicza proces transferu energii w jednym lub drugim systemie.
Rodzaje systemów energetycznych
W świecie fizycznym istnieją dwa rodzaje systemów energetycznych. Układ zamknięty lub zamknięty ma stałą masę. W systemie otwartym lub otwartym masa może się zmniejszać i zwiększać w zależności od procesów zachodzących w tym układzie. Większość obserwowanych systemów jest otwartych. 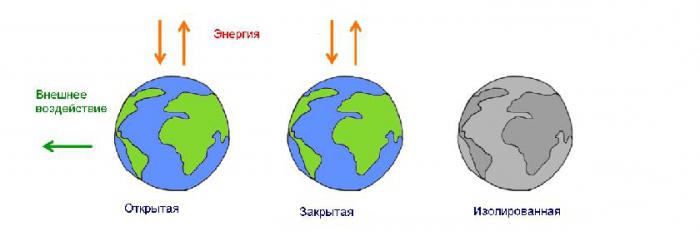 Badania w takich systemach są hamowane przez wiele losowych czynników wpływających na wiarygodność wyników. Dlatego fizycy badają zjawiska w systemach zamkniętych, ekstrapolując wyniki na otwarte, biorąc pod uwagę niezbędne korekty.
Badania w takich systemach są hamowane przez wiele losowych czynników wpływających na wiarygodność wyników. Dlatego fizycy badają zjawiska w systemach zamkniętych, ekstrapolując wyniki na otwarte, biorąc pod uwagę niezbędne korekty.
Izolowana energia systemu
Każdy zamknięty system, w którym nie ma wymiany energii z otoczeniem, jest odizolowany. Stan równowagi takiego układu określają wskazania takich wielkości:
Ad
- P - ciśnienie w układzie;
- V to objętość izolowanego systemu
- T to temperatura;
- n oznacza liczbę moli gazu w układzie;
Jak widać, ilość ciepła i wykonanej pracy nie są uwzględnione na tej liście. Zamknięty, izolowany system nie wykonuje wymiany ciepła i nie wykonuje pracy. Jej całkowita energia pozostaje niezmieniona.
Zmiana energii systemu
Po zakończeniu pracy lub wymianie ciepła, stan systemu ulega zmianie i nie zostanie uznany za izolowany.
Formułowanie pierwszej zasady termodynamiki
Energia wewnętrzna System zamknięty składa się z sumy energii wszystkich cząstek tego układu. Energię tę można zmienić tylko działając na system z zewnątrz. Energia wewnętrzna takiego zamkniętego układu zwiększy się albo z powodu pracy, która została wykonana w systemie, albo dlatego, że pewna ilość ciepła jest przekazywana do takiego układu. Zmniejszenie całkowitej energii systemu zależy również od dwóch czynników - albo wydziela ciepło, albo wykona pewną pracę.
Ad
Zmianę ilości energii całkowitej można wyrazić za pomocą wzoru, który będzie wyglądał następująco: 
Jeśli mówimy o pracy wykonanej w systemie, to zmienna W będzie ujemny. Ta formuła stanowi pierwszą zasadę termodynamiki.
Prawo ochrony
To prawo jest uważane za jedno z fundamentalnych praw fizyki. Ciepło i praca są głównymi środkami przekazywania energii, a zmiana wewnętrznej energii systemu zależy bezpośrednio od tych wielkości. W ten sposób modyfikowana jest pierwsza zasada termodynamiki prawo zachowania energii.
Przede wszystkim powstała pierwsza zasada termodynamiki dla systemów izolowanych. Później udowodniono, że prawo jest uniwersalne i można je zastosować do systemów otwartych, jeśli weźmiemy pod uwagę zmianę energii wewnętrznej, która występuje z powodu wahań ilości substancji w systemie. Jeżeli rozpatrywany system przechodzi od stanu A do stanu B, wówczas praca wykonana przez system W i ilość ciepła Q będą się różnić. Różne procesy powodują nierówne odczyty tych zmiennych, nawet jeśli system ostatecznie osiąga swój pierwotny stan. Ale różnica polega na W - Q zawsze będzie taki sam. Innymi słowy, jeśli po jakimkolwiek uderzeniu system powrócił do swojego pierwotnego stanu, to niezależnie od rodzaju procesów związanych z transformacją takiego systemu, przestrzegana jest reguła W - Q = const .
Ad
W niektórych przypadkach wygodniej jest stosować formułę różniczkową do wyrażania pierwszego prawa. Wygląda to tak: dU = dW- dQ
tutaj dU - nieskończenie mała zmiana w energii wewnętrznej
dW - wartość charakteryzująca nieskończenie małą operację systemu
dQ - nieskończenie mała ilość ciepła przekazywana do tego systemu.
Entalpia
W celu szerszego zastosowania pierwszej zasady termodynamiki wprowadzono pojęcie entalpii.
Jest to nazwa całkowitej ilości całkowitej energii substancji i iloczynu objętości i ciśnienia. Fizyczną ekspresję entalpii można przedstawić za pomocą następującej formuły:
H = U + pV
Bezwzględna wartość entalpii jest sumą entalpii wszystkich części tworzących system. 
W kategoriach ilościowych tej wartości nie można określić. Fizycy działają tylko z różnicą entalpii ostatecznego i początkowego stanu systemu. Wszakże w przypadku jakichkolwiek obliczeń, zmiany w stanie systemu wybierają pewien poziom, na którym potencjalna energia jest równa zero. Podobnie robią to przy obliczaniu entalpii. Jeśli zastosujemy pojęcie entalpii, to pierwsza zasada termodynamiki dla izoprocesów będzie wyglądać następująco: dU = dW- dH
Entalpia każdego układu zależy od wewnętrznej struktury substancji tworzących ten układ. Te wskaźniki z kolei zależą od struktury substancji, jej temperatury, ilości i ciśnienia. W przypadku substancji złożonych możliwe jest obliczenie standardowej entalpii tworzenia, która jest równa ilości ciepła potrzebnego do utworzenia molowej substancji z prostych składników. Z reguły standardowa wartość entalpii jest ujemna, ponieważ w syntezie złożonych substancji w większości przypadków uwalniane jest ciepło.
Ad
Pierwsza zasada termodynamiki w procesach adiabatycznych
Zastosowanie pierwszej zasady termodynamiki dla izoprocesów można rozpatrywać graficznie. Weźmy na przykład proces adiabatyczny, w którym ilość ciepła pozostaje stała przez cały czas, czyli Q = const . Taki izoproces przebiega w systemach z izolacją cieplną lub w tak krótkim czasie, że system nie ma czasu na przeprowadzenie wymiany ciepła ze środowiskiem zewnętrznym. Powolne rozprężanie gazu na wykresie objętościowo-ciśnieniowym jest opisane za pomocą następującej krzywej:
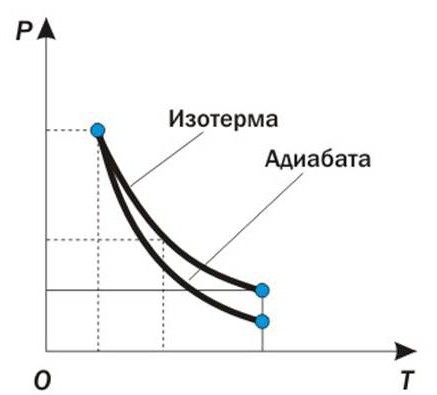
Zgodnie z harmonogramem możliwe jest uzasadnienie zastosowania pierwszej zasady termodynamiki do izoprocesów. Ponieważ nie ma zmiany w ilości ciepła w procesie adiabatycznym, zmiana energii wewnętrznej jest równa ilości wytworzonej pracy. dU = - dW
Wynika z tego, że energia wewnętrzna układu maleje, a jego temperatura spada.
Przykłady procesów adiabatycznych
Odwrotność jest również prawdą: spadek ciśnienia przy braku wymiany ciepła znacznie zwiększa temperaturę układu. W przybliżeniu tak, że gaz rozszerza się w silnikach spalinowych. W silnikach diesla gaz palny jest sprężany 15 razy. Krótkotrwały wzrost temperatury umożliwia samozapalenie się mieszaniny palnej. 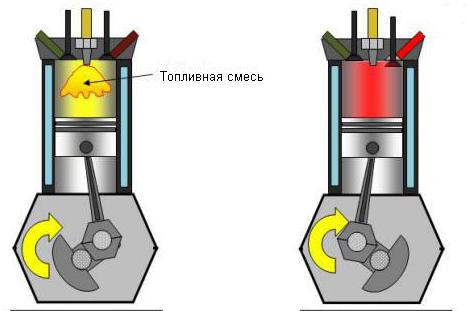
Można rozważyć inny przykład procesu adiabatycznego - swobodną ekspansję gazów. Aby to zrobić, rozważ tę instalację, składającą się z dwóch zbiorników: 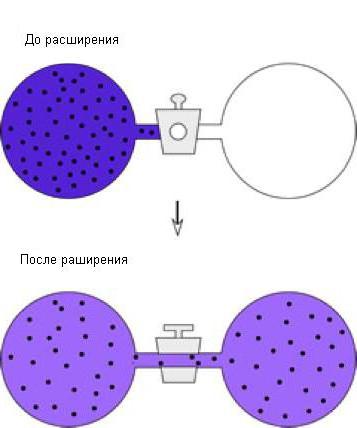
W pierwszym zbiorniku znajduje się gaz, w drugim nie ma go. Obracając kurek, zapewnimy, że gaz wypełni cały przydzielony mu wolumen. Przy wystarczającej izolacji układu temperatura gazu pozostanie niezmieniona. Ponieważ gaz nie działał, zmienna dW = const . Okazało się, że inne rzeczy są równe, temperatura gazu zmniejsza się podczas ekspansji. Ekspansja gazu jest nierównomierna, dlatego procesu tego nie można przedstawić na wykresie ciśnienia i objętości.
Pierwsza zasada termodynamiki jest uniwersalnym prawem, które stosuje się do wszystkich widocznych procesów Wszechświata. Dogłębne zrozumienie przyczyn pewnych przemian energetycznych pozwala nam zrozumieć istniejące zjawiska fizyczne i odkryć nowe prawa.