Prawo zachowania masy w chemii. Odkrycie prawa
Prawo zachowania masy jest podstawą do obliczania procesów fizycznych we wszystkich sferach ludzkiej działalności. Jego sprawiedliwość nie jest kwestionowana przez fizyków, chemików czy przedstawicieli innych nauk. Prawo to, jako ścisły księgowy, monitoruje zgodność z dokładną masą substancji przed i po interakcji z innymi substancjami. Honor odkrycia tego prawa należy do rosyjskiego naukowca M. V. Lomonosova.
Wstępne zrozumienie składu substancji
Struktura materii przez wieki pozostawała tajemnicą dla każdej osoby. Różne hipotezy poruszały umysły naukowców i motywowały mędrców do długich i bezsensownych sporów. Jeden twierdził, że wszystko składało się z ognia, a drugi bronił zupełnie innego punktu widzenia. W masie teorii błysnęło i niesprawiedliwie zapomniano teorię starożytnego mędrca greckiego Demokryta, że wszystkie substancje składają się z maleńkich, drobnych cząstek materii niewidocznych dla oka. Demokryt nazwał je "atomami", co oznacza "niepodzielne". Niestety, przez 23 wieki, jego założenie zostało zapomniane.
Alchemia
Większość danych naukowych w średniowieczu opierała się na uprzedzeniach i różnych spekulacjach. Alchemia powstaje i jest szeroko rozpowszechniona, co było zbiorem skromnej wiedzy praktycznej, ściśle przyprawionej fantastycznymi teoriami. Na przykład, dobrze znane umysły tamtych czasów próbowały zamienić ołów w złoto i znaleźć nieznany kamień filozoficzny, który wyleczył wszystkie choroby. W procesie poszukiwania stopniowo gromadzone doświadczenie naukowe, składające się z wielu niewyjaśnionych reakcji pierwiastków chemicznych. Na przykład stwierdzono, że wiele substancji, zwanych później prostymi, nie rozpada się. W ten sposób odrodziła się starożytna teoria niepodzielnych cząstek materii. Potrzeba było wielkiego myślenia, aby ten magazyn informacji przekształcić w spójną i logiczną teorię. 
Teoria Lomonosova
Dokładna ilościowa metoda chemii badawczej jest obowiązkowa dla rosyjskiego naukowca M. V. Łomonosowa. Za swoje genialne zdolności i ciężką pracę otrzymał tytuł profesora chemii i został członkiem Rosyjskiej Akademii Nauk. Pod nim zorganizowano pierwsze nowoczesne laboratorium chemiczne w kraju, w którym odkryto słynne prawo zachowania masy substancji. 
W trakcie badania przepływu reakcje chemiczne Łomonosow ważył oryginalne chemikalia i produkty, które pojawiły się po reakcji. W tym samym czasie odkrył i sformułował prawo zachowania masy materii. W XVII wieku pojęcie masy często mylono z terminem "waga". Dlatego masy substancji są często nazywane "ciężarkami". Łomonosow ustalił, że struktura materii jest bezpośrednio zależna od cząstek, z których jest zbudowana. Jeśli zawiera cząstki tego samego rodzaju, naukowiec nazwał taką substancję prostą. Przy heterogenicznym składzie ciałek otrzymuje się substancję złożoną. Te teoretyczne dane pozwoliły Lomonosovowi sformułować prawo ochrony masy.
Definicja prawa
Po wielu eksperymentach MV Łomonosow ustanowił prawo, którego istota była następująca: masa substancji, które weszły w reakcję, jest równa masie substancji, które zostały uzyskane w wyniku reakcji. 
W nauce rosyjskiej ten postulat nosi nazwę "Prawo zachowania masy substancji Łomonosowa".
To prawo zostało sformułowane w 1748 roku, a najdokładniejsze eksperymenty z reakcją spalania metali w zamkniętych naczyniach przeprowadzono w 1756 roku.
Eksperymenty Lavoisiera
Nauka europejska odkryła prawo zachowania masy po opublikowaniu opisu dzieł wielkiego francuskiego chemika Antoine Lavoisiera.  Ten naukowiec odważnie zastosował teoretyczne idee i fizyczne metody czasu w swoich eksperymentach, co pozwoliło mu rozwinąć chemiczną nomenklaturę i stworzyć rejestr wszystkich znanych w tym czasie chemikaliów.
Ten naukowiec odważnie zastosował teoretyczne idee i fizyczne metody czasu w swoich eksperymentach, co pozwoliło mu rozwinąć chemiczną nomenklaturę i stworzyć rejestr wszystkich znanych w tym czasie chemikaliów.
Poprzez swoje eksperymenty Lavoisier udowodnił, że w trakcie każdej reakcji chemicznej obserwuje się prawo zachowania masy substancji wchodzących do związku. Ponadto rozszerzył rozkład prawa ochrony na masę każdego z pierwiastków biorących udział w reakcji jako część złożonych substancji.
Tak więc na pytanie, kto odkrył prawo zachowania masy substancji można odpowiedzieć dwojako. MV Lomonosov był pierwszym, który przeprowadził eksperymenty, które żywo demonstrują prawo zachowania i postawił go pod teoretyczną podstawą. A. Lavoisier, w 1789 roku, niezależnie od rosyjskiego naukowca, samodzielnie odkrywa prawo masowej konserwacji i rozszerza swoją zasadę na wszystkie elementy związane z reakcją chemiczną.
Masa i energia
W 1905 r. Wielki A. Einstein wykazał związek między masą materii a jej energią. Wyrażono to za pomocą następującego wzoru:
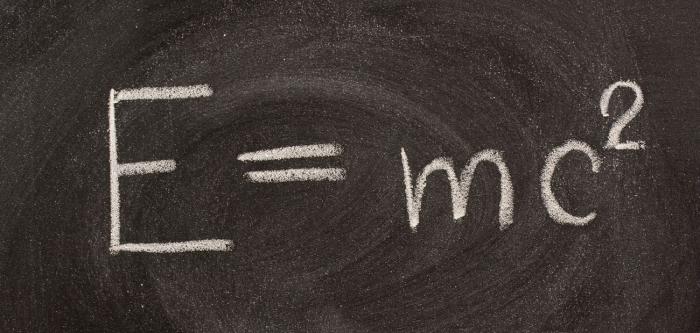
Równanie Einsteina potwierdza prawo zachowania masy i energii. Teoria ta stwierdza, że każda energia ma masę, a zmiana tej energii jest zmianą masy ciała. Potencjał energii każde ciało jest bardzo duże i może się uwolnić jedynie w specjalnych warunkach.
Prawo zachowania masy obowiązuje dla dowolnych ciał mikro i makrokosmosu. W konwersję bierze udział każda reakcja chemiczna energia wewnętrzna substancje. Dlatego przy obliczaniu masy substancji biorących udział w reakcjach chemicznych należałoby wziąć pod uwagę wzrost lub spadek masy spowodowany uwolnieniem lub absorpcją energii w danej reakcji. W rzeczywistości w makrokosmosie efekt ten jest tak niewielki, że takie zmiany można zignorować.