Eter dietylowy: wzór. Eter dietylowy: właściwości fizyczne i chemiczne
Setki lat temu słynny naukowiec Lully, który po jego śmierci został nazwany alchemikiem, był w stanie odkryć niezbędny eter dietylowy. Wzór, właściwości, temperatura wrzenia, metody otrzymywania substancji zostaną szczegółowo opisane w tym artykule. 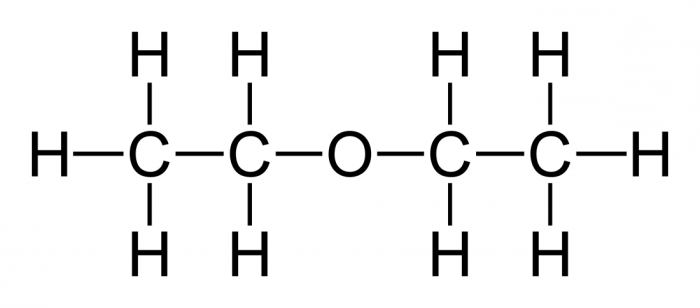
Historia
W XIII wieku słynny hiszpański naukowiec Raymond Llull odkrył eter dietylowy. Jego właściwości zostały opisane w 1540 roku przez nie mniej znanego naukowca Paracelsusa. W 1846 r. Próbowano najpierw użyć eteru jako znieczulenia. Operacja przeprowadzona przez amerykańskiego lekarza D. Warrena z wykorzystaniem oparów tej substancji zakończyła się powodzeniem. Wynalazcy znieczulenia są uważani za dentystę W. Mortona i jego mentora - lekarza i chemika C. Jacksona.
Metody uzyskiwania eteru w XVI wieku opisał Valerius Cordus, słynny botanik i farmaceuta pochodzący z Kassel. Od początku XVIII wieku jako środek uspokajający stosowano mieszankę alkoholowo-eterową - taka była propozycja Friedricha Hoffmanna. Petersburski farmaceuta Thomas Lovits w 1796 roku otrzymał czysty eter dietylowy, którego wzór ma dwie opcje (więcej o tym później). Ale zasadę działania wyżej wymienionej substancji na ludzkim ciele ogłosił angielski fizyk M. Faraday, po czym w 1818 roku opublikowano nawet artykuł naukowy poświęcony temu zagadnieniu. 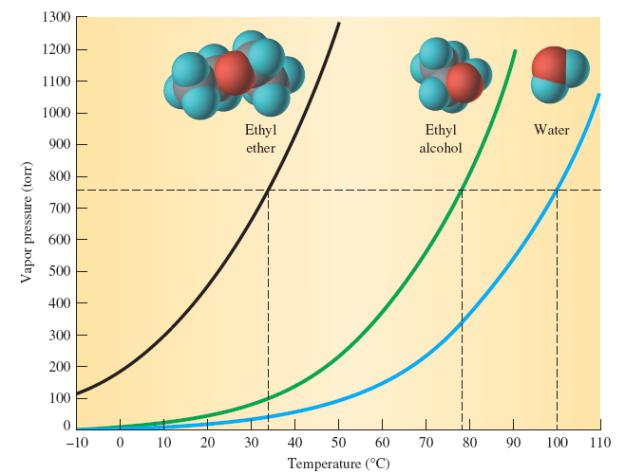
Charakterystyczne
Co nazywa się prostym eterem? Tak jest związek organiczny których cząsteczki składają się z dwóch rodników węglowodorowych i atomu tlenu. Najważniejszy prosty, eter dietylowy, którego wzór ma następującą postać:
(C 2H 5 ) 2O lub C 4 H 10 O.
Jest to bezbarwny, przezroczysty, bardzo mobilny lotny płyn o swoistym zapachu i palącym smaku.
Pod wpływem światła, powietrza, ciepła i wilgoci eter może ulec rozkładowi, tworząc toksyczne aldehydy, nadtlenki i ketony, które podrażniają drogi oddechowe.
Kiedy temperatura wody wynosi 20 stopni, rozpuszcza się o 6,5%. Dobrze miesza się z tłuszczowymi i olejkami eterycznymi, benzenem i alkoholem, bez względu na stosunek.
Sam eter jednak, podobnie jak jego opary, jest łatwopalny. W pewnych proporcjach z tlenem lub powietrzem, pary eteru dietylowego stosowane do znieczulenia są wybuchowe. 
Właściwości chemiczne
Wszystkie właściwości chemiczne eterów są charakterystyczne dla eteru dietylowego. Tak, zajmijmy się tym problemem bardziej szczegółowo. Jest to raczej obojętna substancja. Główną różnicą w stosunku do estrów jest brak hydrolizy, chociaż istnieją wyjątki. Na zimno nie wchodzi w reakcję z chlorkiem fosforu, metalicznym sodem i wieloma rozcieńczonymi kwasami mineralnymi. Pomimo tego skoncentrowany kwasy (siarkowy i jodowodór) rozkładają te estry nawet w niskich temperaturach, a rozgrzany metaliczny sodu dzieli je.
Eter z samotnymi parami elektronów oddziałuje z protonem silny kwas w wyniku czego niestabilny związek oksoniowy:
- Acidolysis. Kwasy siarkowe i jodowodorowe, a także FeCl3 w bezwodniku octowym, są zdolne do rozszczepiania eterów. Reakcja chemiczna przebiega następująco: CH3 - CH2 - O - CH2 - CH3 + HJ → CH3 - CH2 - OH + J - CH2 - CH3.
- Reakcja metalizacji, zwana reakcją Shorygin. Podgrzewany metaliczny dwoina sodowy eter dietylowy: C2H5 - O - C2H5 + 2Na → C2H5ONa + C2H5Na
- Względna obojętność chemiczna nie uniemożliwia tworzenia się estrów w powietrzu z wytworzeniem nadtlenków, co często prowadzi do wybuchów pod koniec destylacji.
Eter dietylowy: właściwości fizyczne
Osobliwy zapach, niska temperatura wrzenia eterów - dowody słabych efektów międzycząsteczkowych, a to wskazuje na niską polarność i brak warunków wstępnych do tworzenia wiązań wodorowych. W przeciwieństwie do alkoholi, estry mają silniejsze właściwości oddawania elektronów, co potwierdzają wartości potencjałów jonizacji. Wzmocnienie tych cech jest związane z dodatnim efektem indukcyjnym grupy atomów, które są otrzymywane z alkanów po usunięciu atomu wodoru. 
Temperatura wrzenia eteru dietylowego wynosi 35,6 stopnia Celsjusza (jest znacznie niższa niż w przypadku izomerycznych alkoholi), a zamrożenie wynosi 117 ° C. Etery prawie nie mieszają się z wodą. Wyjaśnienie tego jest całkiem proste: nie są w stanie utworzyć wiązań wodorowych, ponieważ ich cząsteczki nie mają wiązań polarnych. Słabo rozpuszczalny w wodzie i eterze dietylowym, których gęstość w odniesieniu do tlenku wodoru wynosi 0,714. Jedną z cech danej substancji jest tendencja do elektryzowania. Prawdopodobieństwo wyładowań statycznych jest szczególnie wysokie podczas transfuzji lub rozładowywania składu chemicznego, w wyniku czego może nastąpić zapłon. Pary eteru tworzą się z powietrzem, który jest 2,5 razy lżejszy, wybuchowe mieszaniny. Dolna granica wybuchowości wynosi 1,7%, a górna 49%. Pracując z eterem, nie powinniśmy zapominać, że jego pary mają tendencję do rozprzestrzeniania się na duże odległości bez utraty zdolności spalania. Tak więc głównym środkiem ostrożności jest brak otwartego ognia i innych źródeł zapłonu.
Eter jest słabo aktywnym związkiem, mniej reaktywnym niż alkohole. Niezwykle rozpuszcza większość materii organicznej, więc jest stosowany jako rozpuszczalnik. Wyjątkiem nie jest eter dietylowy. Właściwości fizyczne, a także chemiczne, pozwalają na jego zastosowanie w medycynie i przemyśle.
Otrzymywanie eteru dietylowego
Etery nie występują w naturze - są otrzymywane syntetycznie. Pod wpływem katalizatorów kwasowych alkohol etylowy w podwyższonej temperaturze otrzymuje się eter dietylowy (wzór podany jest powyżej). Najprostszym sposobem uzyskania tej substancji jest destylacja mieszaniny składającej się z kwasu siarkowego i alkoholu. Aby to zrobić, konieczne jest rozgrzanie do 140-150 stopni Celsjusza. Będziemy potrzebować alkoholu etylowego i kwasu siarkowego (w równych proporcjach), pipet, probówek i rury parowe.
Po przygotowaniu sprzętu i odczynników można rozpocząć eksperyment. W probówce (musi być sucha), wlej 2-3 ml mieszaniny alkoholu i kwasu i powoli podgrzej ją. Jak tylko zacznie się gotować, palnik jest usuwany, a 5 do 10 kropli alkoholu etylowego dodaje się do gorącej mieszaniny za pomocą pipety wzdłuż ścianki probówki. Reakcja przebiega w następujący sposób:
- CH3-CH2-OH (kwas etylosiarczkowy) + H2SO4 CH3-CH2-OSO3H + H2O;
- CH3 - CH2 - OSO3H + CH3 - CH3 - O;
- CH3 - CH2 - O - CH2 - CH3 (eter dietylowy) + H2SO4.
O powstawaniu eteru dietylowego świadczy zapach, który się pojawił. 
Używaj w medycynie
Lekarze używają eteru dietylowego jako ogólnego leku znieczulającego. Właściwości tej substancji nie pozwalają na jej stosowanie w operacjach, w których wykorzystywane są narzędzia elektryczne, ponieważ są łatwopalne i mogą eksplodować w połączeniu z powietrzem. Eter dietylowy jest szeroko rozpowszechniony w chirurgii, gdzie stosuje się go do znieczulenia wziewnego. W stomatologii leczone są stomatologicznymi kanałami korzeniowymi i próchnicami, przygotowując w ten sposób jamę ustną do wypełnienia. 
Eter dietylowy jako paliwo
Substancja ma wysoką liczbę cetanową (85-96), dzięki czemu może być wykorzystywana jako płyn wyjściowy do silników benzynowych i wysokoprężnych. Ze względu na dużą zmienność i niskie temperatury zapłonu, eter dietylowy jest stosowany jako składnik mieszaniny paliwowej dla przykładowych silników wysokoprężnych. Okazuje się, że ta substancja jest podobna do etanolu.
Właściwe przechowywanie
Zaleca się, aby eter dietylowy był przechowywany w butelkach o ciemnych kolorach (starannie uszczelnionych) w chłodnym miejscu, ponieważ rozkłada się w świetle, w gorącym i pod wpływem wilgoci, tworząc toksyczne substancje.