Białko fibrylarne: struktura, przykłady
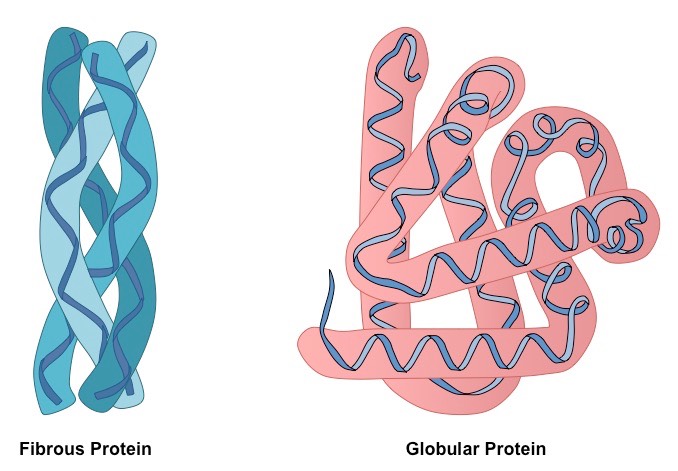
Pod względem ich złożenia w przestrzeni trójwymiarowej rozróżnia się dwie duże grupy białek: kulistą i włóknistą. Większość białek należy do pierwszej frakcji, która odpowiada typowemu modelowi struktury trzeciorzędowej, opisując łańcuch aminokwasowy jako kulistą plątaninę z hydrofobowym centrum i hydrofilową powierzchnią. Włókniste białka są specyficzną grupą charakteryzującą się filamentarną formą cząsteczek.
Ogólna charakterystyka struktury przestrzennej białka
W swojej pierwotnej postaci syntetyzowane białko jest liniowym łańcuchem aminokwasów połączonych ze sobą wiązaniami peptydowymi. Jednak w drodze do końcowej postaci funkcjonalnej cząsteczka przechodzi kilka etapów przestrzennego fałdowania z powodu różnych interakcji chemicznych. Każdy etap formacji wyznaczają odpowiednie struktury: pierwotna, wtórna, trzeciorzędowa i czwartorzędowa (jeśli taka istnieje).
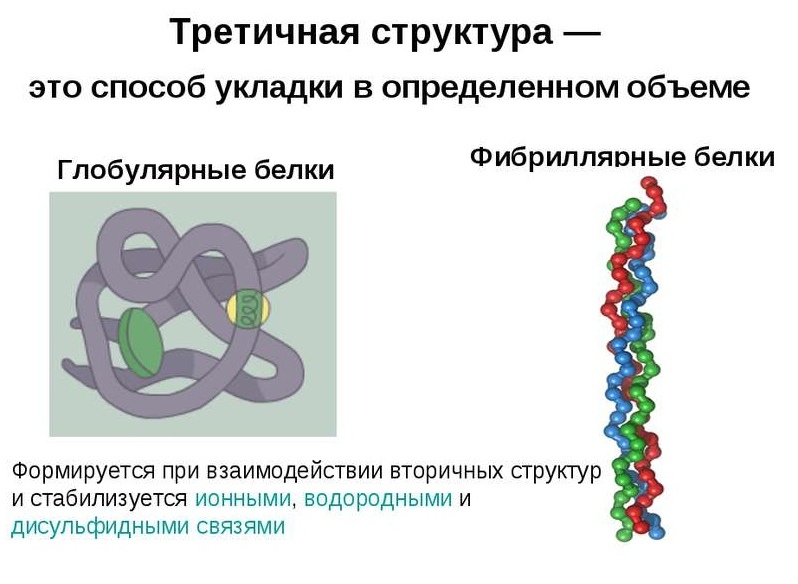
Białka globularne charakteryzują się trójwymiarową konformacją przestrzenną, która jest zatrzymywana przez kompleks słabych wiązań chemicznych (wodór, jon, hydrofobowość itp.). Kształt cząsteczki takiego białka przypomina sferyczną plątaninę.
Łańcuchy polipeptydowe włókien fibrylarnych tworzą długie włókna, które składają się z powtarzających się elementów struktury drugorzędowej. Urządzenie o trzeciorzędowej konformacji włókien ciągłych w porównaniu z globulą jest znacznie prymitywniejsze, jednak zapewnia dobrą stabilność.
Główne różnice białek filamentarnych od sferycznych
Oprócz formy przestrzennej, białka fibrylarne różnią się od kulistych w:
- rozmiar;
- rozpuszczalność;
- funkcje.
Włókniste białka są zwykle większe niż kuliste i są długimi prętami uformowanymi ze spirali. W przeciwieństwie do białek globularnych, przestrzenna konformacja włókien fibrylowych jest zapewniona przez silne wiązania wodorowe. Z tego powodu białka włókniste są bardziej stabilne i nie tak łatwo denaturowane jak kuliste.
W przeciwieństwie do białek globularnych, włóknisty:
- nierozpuszczalny w wodzie, a także słabe kwasy i zasady;
- rozpuszczalny w silnych zasadach i kwasach;
- posiadają właściwości rozciągliwości i kompresji;
- charakteryzuje się wysoką odpornością na enzymy trawienne.
Białka globularne zbudowane są z prostych odcinków struktur drugorzędowych, które w połączeniu ze sobą radykalnie zmieniają kierunek, tworząc trójwymiarową plątaninę. Białka włókniste składają się z jednego elementu, powtarzanego wiele razy.
Cechy włókien fibrylarnych
Różnorodność białek fibrylarnych jest znacznie mniejsza niż kulistość. Ta grupa jest wyspecjalizowaną frakcją białek pełniących głównie funkcje strukturalne. W tym przypadku białka fibrylarne działają na poziomie makro, tworząc duże supramolekularne kompleksy.
Białka włókniste zidentyfikowano tylko u zwierząt. Białka te pełnią funkcję wspomagającą składniki niektórych tkanek. Taka rola biologiczna nakłada zwiększone wymagania na wytrzymałość i uporządkowanie budowy cząsteczek. Z tego powodu struktura włókienkowa białka jest bardziej stabilna niż globula.
Białka włókniste biorą udział w tworzeniu sztywnych struktur, takich jak:
- tkanka łączna;
- ścięgna;
- włókna mięśniowe.
Białka te są częścią różnych formacji powierzchniowych (naskórek, włosy, wełna itp.), Pełniących funkcje ochronne.
W naturalnym środowisku fizjologicznym białka fibrylarne nie występują w roztworze. Jednakże, jeśli sztucznie mieszasz molekuły białka włóknistego z wodą, tworzy się bardzo lepka masa.
Przykłady włókien włóknistych i globularnych
Białka globularne obejmują wszystkie białka rozpuszczone w podłożach międzykomórkowych i wewnątrzkomórkowych, jak również w osoczu krwi. Należą do nich enzymy, hormony białkowe, czynniki transkrypcyjne, immunoglobuliny i tak dalej. Klasyczny przykład globularnego białka można nazwać hemoglobiną.
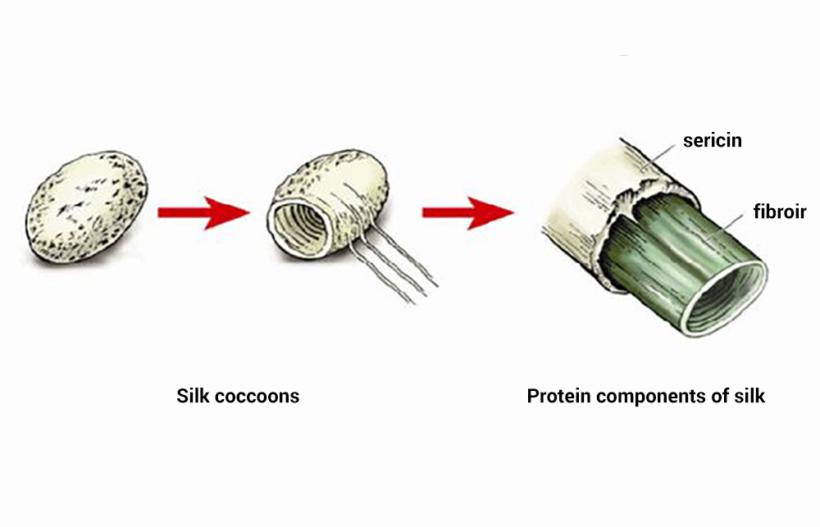
Białka sferyczne spełniają wiele funkcji, podczas gdy białka włókniste - tylko strukturalne. Typowymi przykładami włókien fibrylarnych są kolagen, elastyna i keratyny. Grupa włóknistych białek obejmuje również fibroinę, z której składa się jedwabna nić, oraz fibrynę, która powstaje podczas polimeryzacji fibrynogenu w procesie krzepnięcia krwi.
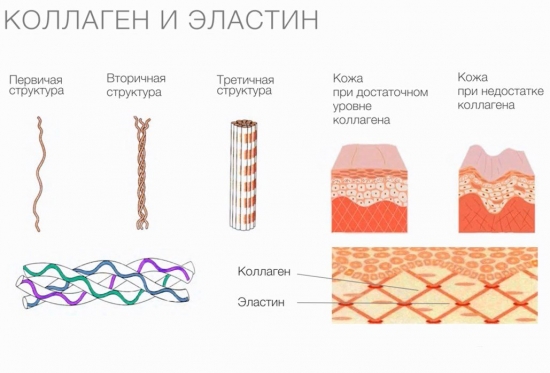
Kolagen
Kolagen jest najbardziej rozpowszechnionym białkiem fibrylarnym zwierząt wielokomórkowych. Jest częścią tkanki łącznej, zapewniając jej wytrzymałość i sprężyste właściwości. Białko to występuje w:
- chrząstka;
- skóra właściwa;
- ścięgna;
- organiczna macierz kostna;
- ściany naczyń;
- organiczny materiał kostny.
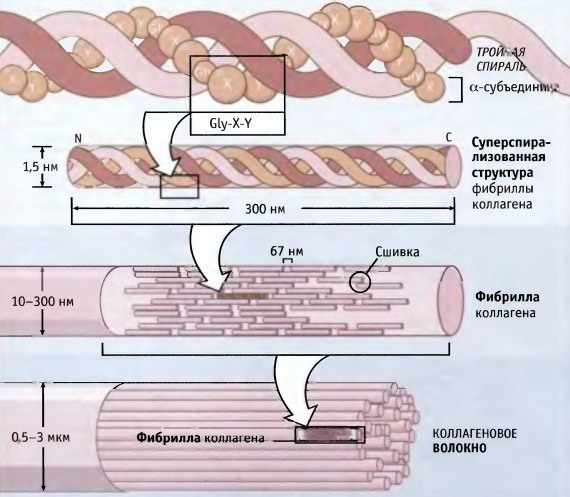
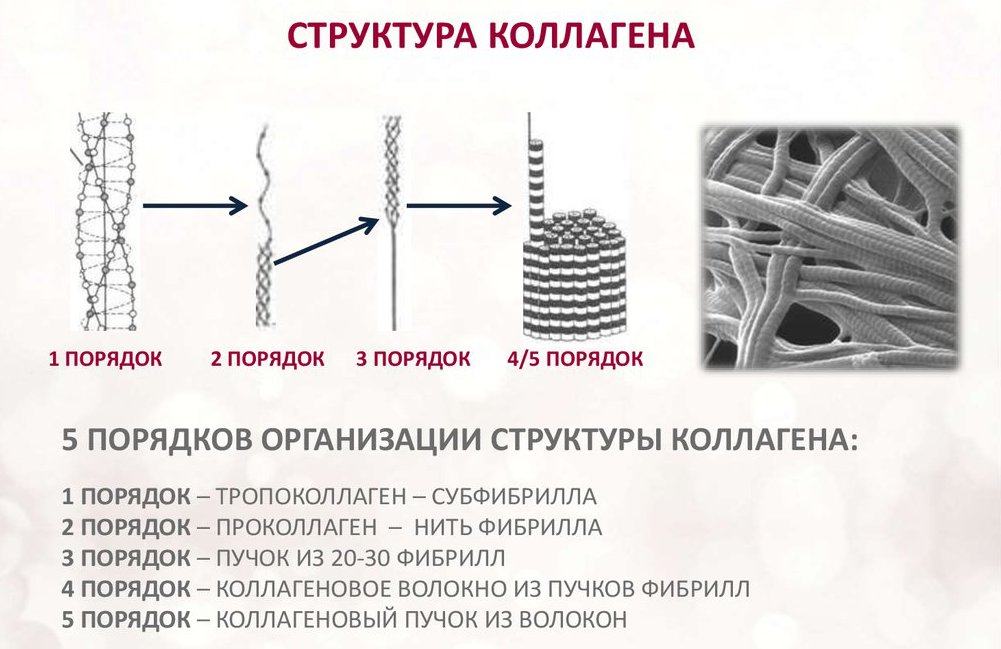
Kolagen składa się z trzech łańcuchów aminokwasów skręconych w spiralę i połączonych ze sobą wiązaniami kowalencyjnymi. Jednostki strukturalne tego białka nazywają się tropokolageny. Te ostatnie są połączone ze sobą za pomocą końców przesuniętych względem siebie o odległość 67 nanometrów.
W zależności od lokalizacji w ciele występuje 28 rodzajów kolagenu. Wszystkie odmiany muszą mieć przynajmniej jedną potrójną domenę helisy. Kolagen stanowi podstawę wszystkich rodzajów tkanki łącznej. Składniki strukturalne tego białka tworzą bardzo silne włókienka, które są w stanie wytrzymać znaczne obciążenia.
Kolagen pełni funkcje wspomagające i ochronne, a także zapewnia elastyczność tkanek. Jednak cząsteczki tego białka nie mają zdolności rozciągania. Właściwości gumowate są charakterystyczne dla innego białka, również obecnego w tkankach łącznych, elastyny.
Keratyny
Istnieją 2 główne typy keratyn: alfa i beta. Pierwsza grupa obejmuje włókniste białka, które są częścią formacji okrywowych kręgowców. Alfa keratyny stanowią większość suchej masy:
- naskórek;
- włosy i wełna;
- pazury i paznokcie;
- kopyta, rogi, muszle, igły itp.
Innymi słowy, keratyny z grupy alfa są strukturalną podstawą do tworzenia pochodnych skóry. Wariant beta tego rodzaju włóknistego białka znajduje się w kompozycji wstęgi i jedwabiu. Te keratyny są bardziej miękkie.
Twarde białka z grupy alfa spełniają funkcje ochronne, a także zapewniają wytrzymałość niektórych części anatomicznych (rogi, kopyta, dzioby). Z powodu keratyny dochodzi do tworzenia się modzeli na uszkodzonej skórze.
Elastyna
Elastyna jest głównym białkowym składnikiem tkanek, które powinny mieć wysokie właściwości plastyczne. To białko jest częścią:
- tętnice;
- płuca;
- ściany pęcherza moczowego;
- skóra;
- elastyczne wiązadła;
- chrząstka.
Podobnie jak inne białka włókniste, elastyna jest zbudowana z elementarnych jednostek powtarzalnych. W tym przypadku działają one jak małe cząsteczki ważące 65 kilodaltonów, które są usieciowane, tworząc nierozpuszczalny kompleks. Każda jednostka strukturalna nazywa się protoelastin.