Jak tworzyć izomery: formuły
Spróbuj wymyślić, jak tworzyć izomery. materia organiczna. Na przykład weź nasycone i nienasycone węglowodory.
Definicja
Najpierw dowiedz się, czym jest izomeria. W zależności od liczby atomów węgla w cząsteczce możliwe jest tworzenie związków różniących się strukturą, właściwościami fizycznymi i chemicznymi. Izomeria jest zjawiskiem wyjaśniającym różnorodność substancji organicznych.
Izomeria nasyconych węglowodorów
Jak tworzyć izomery, dzwonić do przedstawicieli tej klasy związki organiczne? Aby poradzić sobie z zadaniem, na początek wybieramy charakterystyczne cechy tej klasy substancji. Nasycone węglowodory mają ogólny wzór SpN2n + 2, tylko proste (pojedyncze) wiązania są obecne w ich cząsteczkach. Izomeria dla przedstawicieli pewnej liczby metanu sugeruje istnienie różnych substancji organicznych, które mają ten sam skład jakościowy i ilościowy, ale różnią się sekwencją rozmieszczenia atomów.
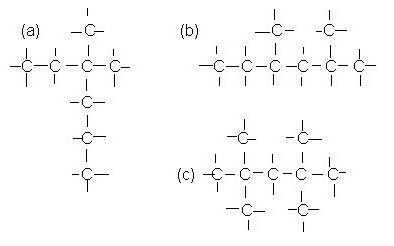
W obecności nasyconych węglowodorów o czterech lub więcej atomach węgla w kompozycji obserwuje się izomerię szkieletu węglowego dla członków tej klasy. Na przykład, możliwe jest sformułowanie wzoru substancji izomerów o składzie C5H12 w postaci normalnego pentanu, 2-metylobutanu, 2,2-dimetylopropanu.
Sekwencja
Strukturalne izomery charakterystyczne dla alkanów są kompilowane przy użyciu określonego algorytmu działania. Aby zrozumieć, jak komponować izomery węglowodorów nasyconych, przyjrzyjmy się temu zagadnieniu bardziej szczegółowo. Po pierwsze, rozważamy bezpośredni łańcuch węglowy, który nie ma dodatkowych gałęzi. Na przykład w obecności sześciu atomów węgla w cząsteczce można utworzyć formułę heksanu. Ponieważ alkan ma wszystkie pojedyncze wiązania, dla nich można napisać tylko izomery strukturalne.
Izomery strukturalne
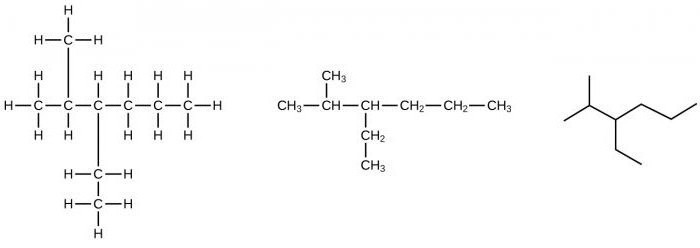
Aby sformułować wzory możliwych izomerów, szkielet węglowy jest skrócony o jeden atom C, zamienia się w cząstkę aktywną - rodnik. Grupa metylowa może znajdować się we wszystkich atomach w łańcuchu, z wyłączeniem skrajnych atomów, tworząc w ten sposób różne organiczne pochodne alkanów.
Na przykład możesz przygotować wzór 2-metylopentan, 3-metylopentan. Następnie liczba atomów węgla w głównym (głównym) łańcuchu zmniejsza się o jeszcze jedną, w wyniku czego pojawiają się dwie aktywne grupy metylowe. Mogą być zlokalizowane przy tych samych lub sąsiednich atomach węgla, z uzyskaniem różnych związków izomerycznych.
Na przykład można utworzyć wzory dwóch izomerów: 2,2-dimetylobutanu, 2,3-dimetylobutanu, różniących się właściwościami fizycznymi. W następstwie skracania podstawowego szkieletu węglowego można uzyskać inne izomery strukturalne. Tak więc, dla węglowodorów szeregu ograniczającego, zjawisko izomerii tłumaczy się obecnością pojedynczych (prostych) wiązań w ich cząsteczkach.
Cechy izomerii alkenów
Aby zrozumieć, jak tworzyć izomery, należy zwrócić uwagę na szczególne cechy tej klasy substancji organicznych. Mamy ogólną formułę SpN2p. W cząsteczkach tych substancji, oprócz pojedynczego wiązania, występuje również podwójne wiązanie, które wpływa na ilość związków izomerycznych. Oprócz izomerii strukturalnej charakterystycznej dla alkanów, dla tej klasy można również wyodrębnić izomerię położenia wiązania wielokrotnego, izomerię międzyklasową.
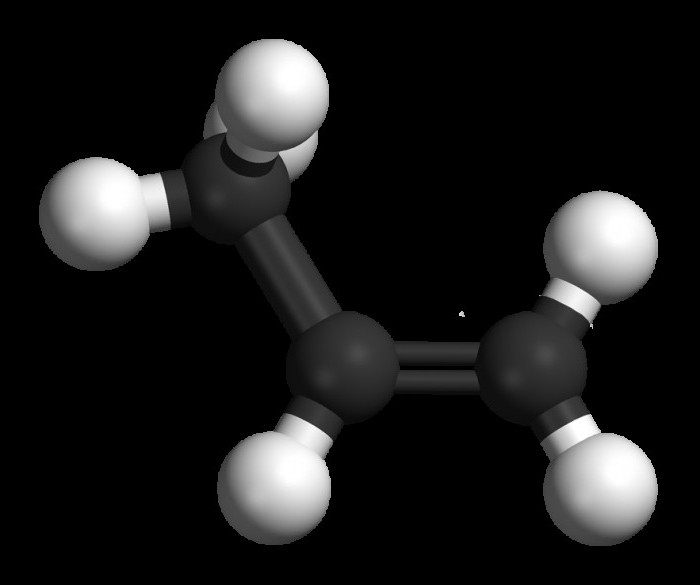
Na przykład dla węglowodorów C4H8 można sformułować dwie formuły, które różnią się układem podwójnego wiązania: buten-1 i buten-2.
Aby zrozumieć, jak tworzyć izomery o ogólnym wzorze C4H8, trzeba mieć pomysł, że oprócz alkenów, cykliczne węglowodory mają taką samą ogólną formułę. Jako izomery należące do związków cyklicznych można przedstawić cyklobutan jak również metylocyklopropan.
Ponadto wzory izomerów geometrycznych można zapisać dla nienasyconych związków z serii etylenu: formy cis i trans. Dla węglowodorów, które mają podwójne wiązanie między atomami węgla, charakterystycznych jest kilka typów izomerii: strukturalnych, międzyklasowych, geometrycznych.
Alkiny
W przypadku związków należących do tej klasy węglowodorów, ogólnym wzorem jest SpN2p-2. Wśród wyróżniających cech tej klasy można wymienić obecność potrójnego wiązania w cząsteczce. Jeden z nich jest prosty, utworzony przez chmury hybrydowe. Dwa wiązania powstają, gdy zachodzą na siebie niehybrydowe chmury, które określają cechy izomerii tej klasy.
Na przykład dla węglowodoru C5H8 można sporządzić formuły substancji mających nierozgałęziony łańcuch węglowy. Ponieważ istnieje związek wielokrotny w oryginalnym związku, może on być różnie zlokalizowany, tworząc penty-1, penty-2. Na przykład, możliwe jest napisanie rozwiniętej i zredukowanej formuły związku o zadanym składzie jakościowym i ilościowym, w którym łańcuch węglowy zostanie zredukowany o jeden atom, który będzie reprezentowany w związku jako rodnik. Ponadto istnieją izomery sprzężone dla alkinów, które są węglowodorami dienowymi.
Dla węglowodorów, które mają potrójne wiązanie, można komponować izomery szkieletu węglowego, pisać wzory dienu, a także rozważać związki o innym układzie wiązań wielokrotnych.
Wniosek
Przy wytwarzaniu wzorów strukturalnych substancji organicznych, atomy tlenu i atomy węgla mogą być rozmieszczone na różne sposoby, tworząc substancje zwane izomerami. W zależności od specyfiki klasy związków organicznych liczba izomerów może być różna. Na przykład dla węglowodorów z szeregu ograniczającego, które obejmują związki z szeregu metanowego, charakterystyczna jest tylko izomeria strukturalna.
W przypadku homologów etylenu, które charakteryzują się obecnością wiązań wielokrotnych (podwójnych), oprócz izomerów strukturalnych można również uwzględnić izomerię położenia wiązań wielokrotnych. Ponadto, inne związki należące do klasy cykloalkanów mają taki sam ogólny wzór, to znaczy możliwa jest izomeria międzyklasowa.
W przypadku substancji zawierających tlen, na przykład, w przypadku kwasów karboksylowych można również zapisać formuły izomerów optycznych.