Wodorotlenek litu. Przykłady reakcji chemicznych, a także właściwości fizycznych alkaliów i ich właściwości
Co to jest wodorotlenek litu? Ten związek jest jednym z najważniejszych związków odpornych na ciepło stosowanych w produkcji do wytwarzania różnych soli litu. Jony tego pierwiastka mają wiele charakterystycznych cech, które znalazły szerokie zastosowanie w produkcji chemicznej.
Cechy struktury atomu litu
Lit (Li) jest elementem grupy I głównej podgrupy drugiego okresu i należy do grupy metale alkaliczne. Jest często określane jako przejście do pierwiastków ziem alkalicznych, ponieważ ma nieco mniejszą aktywność niż następujący członkowie tej grupy, na przykład, sodu (Na) lub potasu (K).
Atom litu ma najmniejszy promień spośród wszystkich metali alkalicznych, co powoduje jego aktywność chemiczną. Szczególną rolę odgrywa stabilna powłoka elektronowa 1s 2 typu helu, która poprzedza elektrony walencyjne 2s 1 , co powoduje wysoką polaryzowalność cząstki.
Ta właściwość litu charakteryzuje występowanie pól elektromagnetycznych lub dipolowych wokół atomu, co pozwala na tworzenie silnych jonów złożonych, takich jak [Li (NH3) n ] + . Należy zauważyć, że przy takich właściwościach sam atom nie podlega polaryzacji, co wyjaśnia niestabilność termiczną niektórych jego soli, szczególnie w przypadku anionów złożonych.
Wszystkie powyższe fakty objaśniają niektóre cechy fizycznych i chemicznych właściwości wodorotlenku litu (LiOH).

Właściwości fizyczne
Czysty LiOH jest bardzo żrącą substancją, która może niszczyć szkło i porcelanę, więc jest przechowywany w woskowanych naczyniach. W stanie stopionym można go uzyskać tylko w naczyniach niklowych lub srebrnych, ponieważ utlenia większość metali i stopów. Złoto jest jedną z niewielu substancji odpornych na działanie takiego związku.
Sama baza, w porównaniu z tlenkiem Li2O, jest chemicznie nietrwała i bliższa 1000 ° C w atmosferze wodoru, H2 rozkłada się na jego składniki (przykład 1).
Tlenek litu i wodorotlenek litu w stanie chemicznie czystym są ciałami stałymi, względnie rozpuszczalnymi w wodzie, ale mniejszymi (prawie 5 razy) niż podobne związki następujących członków grupy. Najwyższy punkt rozpuszczania w opisanej zasadzie wynosi 100 ° C - 17,5 g / 100 g rozpuszczalnika, podczas gdy na przykład przy wodorotlenku sodu (NaOH) wynosi 337 g / 100 g i nadal wzrasta wraz ze wzrostem temperatury. Równocześnie rozpuszczalność wodorotlenku litu jest prawie 100 razy większa niż rozpuszczalność wapna gaszonego (Ca (OH) 2 ), w którym zdolność ta maleje wraz ze wzrostem temperatury.
Co ciekawe, eksperymentalnie możliwe było uzyskanie gazowego LiOH w obecności pary wodnej. Jest on wytwarzany przez ogrzewanie tlenku Li do 2000 ° C, kiedy po osiągnięciu kamienia milowego w temperaturze 1000 ° C ciśnienie pary tego związku wzrasta z powodu tworzenia stabilnej zasady macierzystej (przykład 2).
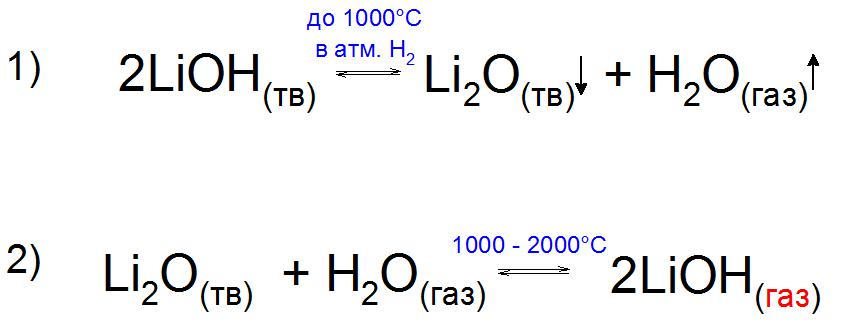
Właściwości chemiczne
Wodorotlenek litu nie jest uważany za kwas, ponieważ nie jest on pierwiastkiem amfoterycznym i nie wykazuje zdolności do rozkładu zgodnie z typem MeOH ↔ MeO - + H + (gdzie, Me jest dowolnym metalem z Grupy I lub II w głównej podgrupie), podobnie jak inni przedstawiciele metali alkalicznych. Uważa się, że takie związki są bardzo silnymi zasadami, ponieważ ich stała dysocjacji zgodnie z zasadą MeOH ↔ Me + + OH jest bardzo wysoka ( Kb, LiOH = 6,75 · 10 -1 ).
Ponieważ taki związek wykazuje silne podstawowe właściwości, może on wchodzić w reakcje neutralizacji z kwasami tlenki kwasów i wymianę z różnymi solami (przykład 3).
Typową reakcją jest oddziaływanie zimnych i gorących stężonych roztworów wodorotlenku litu z gazowym chlorem, z wytworzeniem podchlorynów i chloranów litu (przykład 4).
Cechą tej zasady jest oddziaływanie z gorącym roztworem nadtlenku wodoru H 2 O 2 z utworzeniem krystalicznego hydratu nadtlenku litu Li 2 O 2 w etanolu, podzielonym na próżnię (przykład 5).
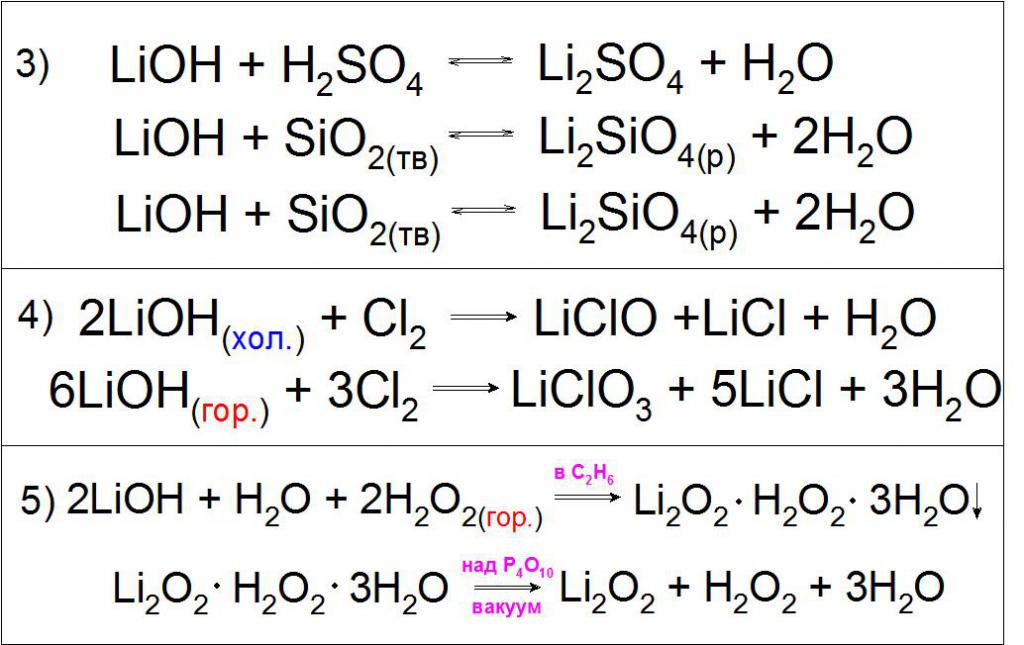
Pierwsze
LiOH otrzymuje się na różne sposoby, z których jednym jest bezpośrednie oddziaływanie metalu lub jego tlenku z wodą zgodnie ze schematem lit → tlenek litu → wodorotlenek litu.

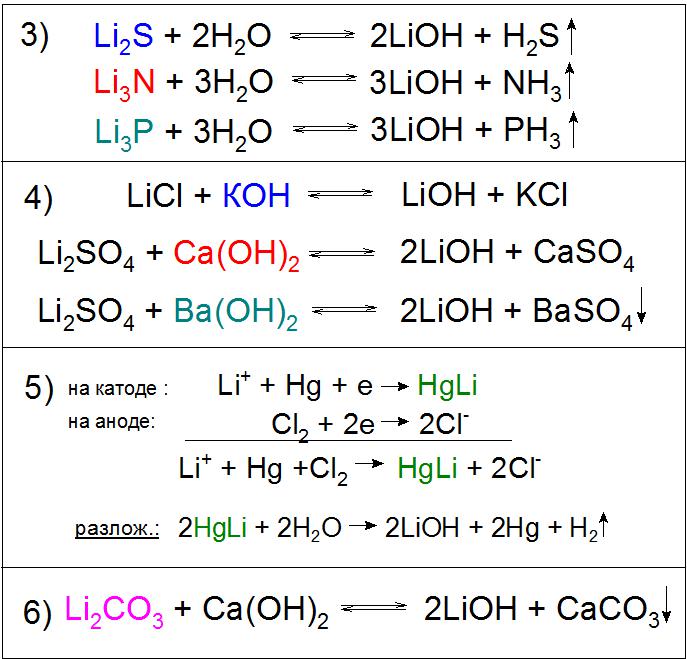
Stosuje się również hydrolizę siarczków, azotków, fosforków i innych związków (Przykład 3).
Reakcje wymiany soli litu są możliwe z niemal dowolnego powodu, na przykład wodorotlenek potasu (KOH), wapń (Ca (OH) 2 ) i bar (Ba (OH) 2 ), a także ostatnie oddziaływanie chemiczne odczynnika prawie w całości przechodzi z siarczanem Li. W pierwszym i drugim przypadku reakcja będzie uzasadniona ze względu na słabą rozpuszczalność otrzymanych soli w roztworze LiOH (przykład 4), aw trzecim - do tego dodaje się nierozpuszczalny w wodzie BaSO 4 (przykład 4). Należy zauważyć, że ta ostatnia opcja nie jest wykorzystywana w produkcji z przyczyn ekonomicznych.
Inną godną uwagi metodą uzyskiwania tego związku jest elektroliza roztworu chlorku litu LiCl na katodzie rtęci. W ten sposób powstaje amalgamat HgLi, interesujący, ponieważ jego temperatura topnienia jest znacznie wyższa (609 ° C) niż którykolwiek z jego składników. W procesie rozkładu przez wodę uzyskanego związku tworzy się niezbędną zasadę (Przykład 5).
Szczególne znaczenie przemysłowe ma reakcja rozkładu węglanu litu z wapnem gaszonym, podczas którego równowaga chemiczna sztucznie przesunięte na prawą stronę dla wyższej wydajności głównego produktu (przykład 6).
Aplikacja
Wodorotlenek litu jest stosowany do wytwarzania stearynianów tego metalu do produkcji wodoodpornych mrozoodpornych smarów. Jest również stosowany jako katalizator w produkcji materiałów polimerowych i jako składnik elektrolitu w różnych bateriach.

W praktyce pożarowej i wojskowej wodorotlenek litu jest stosowany jako pochłaniacz dwutlenku węgla (CO2) w maskach gazowych.