Sprzężenie peptydowe jest podstawą pierwotnej struktury białka. Charakterystyka i tworzenie wiązań peptydowych
Wiązanie peptydowe jest silnym związkiem między fragmentami dwóch aminokwasów leżących u podstaw tworzenia się liniowych struktury białkowe i peptydy. W takich cząsteczkach każdy aminokwas (z wyjątkiem terminali) jest łączony z poprzednim i następnym.
W zależności od liczby ogniw, wiązania peptydowe mogą tworzyć dipeptydy (składające się z dwóch aminokwasów), tripeptydy (z trzech), tetrapeptydy, pentapeptydy itd. Krótkie łańcuchy (od 10 do 50 monomerów) nazywane są oligopeptydami, a długie - polipeptydy i białka ( masa molowa ponad 10 tysięcy.) Tak.
Charakterystyka wiązania peptydowego
Wiązanie peptydowe jest kowalencyjnym związkiem chemicznym pomiędzy pierwszym atomem węgla jednego aminokwasu i atomem azotu innego, wynikającym z oddziaływania grupy alfa-karboksylowej (COOH) z grupą alfa-aminową (NH2). Gdy to nastąpi, nukleofilowe podstawienie OH-hydroksylem na grupie aminowej, z którego oddziela się wodór. W wyniku tego powstaje pojedyncze wiązanie CN i cząsteczka wody.
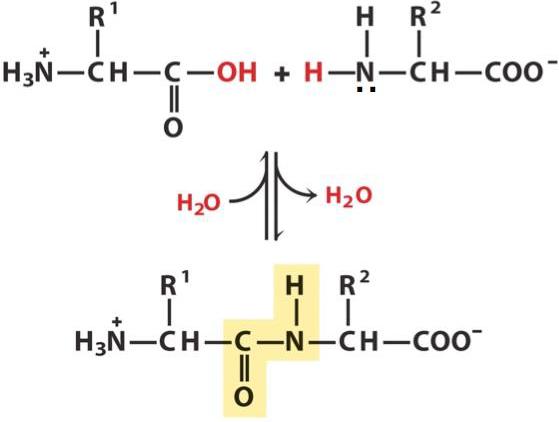
Ponieważ podczas reakcji niektóre składniki (grupy OH i atom wodoru) są tracone, jednostki peptydowe nie są już nazywane aminokwasami, ale resztami aminokwasowymi. Ze względu na to, że te ostatnie zawierają po 2 atomy węgla, w łańcuchu peptydowym zachodzi naprzemienne wiązanie C-C i CN, które tworzą szkielet peptydowy. Po bokach znajdują się rodniki aminokwasowe. Odległość między atomami węgla i azotu waha się od 0,132 do 0,127 nm, co wskazuje na nieskończone wiązanie.
Wiązanie peptydowe jest bardzo silną formą oddziaływania chemicznego. W standardowych warunkach biochemicznych odpowiadających środowisku komórkowemu nie ulega samozniszczeniu.
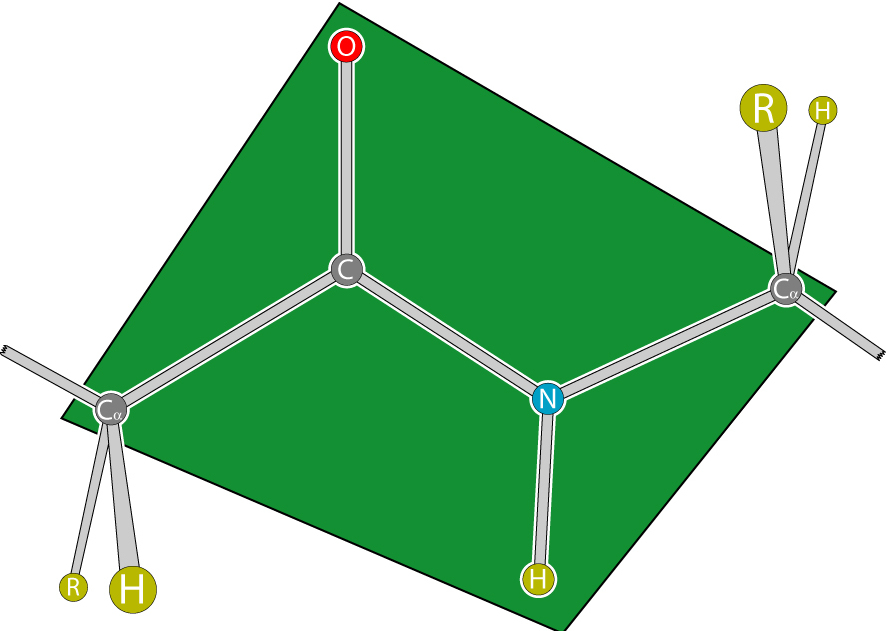
Wiązanie peptydowe białek i peptydów charakteryzuje się właściwością koplanarności, ponieważ wszystkie atomy zaangażowane w jego tworzenie (C, N, O i H) znajdują się w tej samej płaszczyźnie. Zjawisko to tłumaczy się sztywnością (tj. Niemożliwością obracania elementów wokół wiązania) wynikającą ze stabilizacji rezonansowej. W łańcuchu aminokwasowym pomiędzy płaszczyznami grup peptydowych są atomy węgla α związane z rodnikami.
Rodzaje konfiguracji
W zależności od pozycji atomów węgla alfa w stosunku do wiązania peptydowego, ta ostatnia może mieć 2 konfiguracje:
- "cis" (umieszczony z jednej strony);
- "trance" (są z różnych stron).
Forma trans jest bardziej odporna. Czasami konfiguracje charakteryzują się położeniem rodników, co nie zmienia istoty, ponieważ są one związane z atomami węgla alfa.
Zjawisko rezonansu
Osobliwością wiązania peptydowego jest to, że jest 40% podwójny i może występować w trzech postaciach:
- Ketol (0,132 nm) - wiązanie CN jest stabilizowane i całkowicie pojedyncze.
- Postać przejściowa lub mezomeryczna - pośrednia ma częściowo nieokreślony charakter.
- Enol (0,127 nm) - wiązanie peptydowe staje się całkowicie podwójne, a związek C - O całkowicie pojedynczy. W tym przypadku tlen uzyskuje częściowo ujemny ładunek, a atom wodoru - częściowo dodatni.
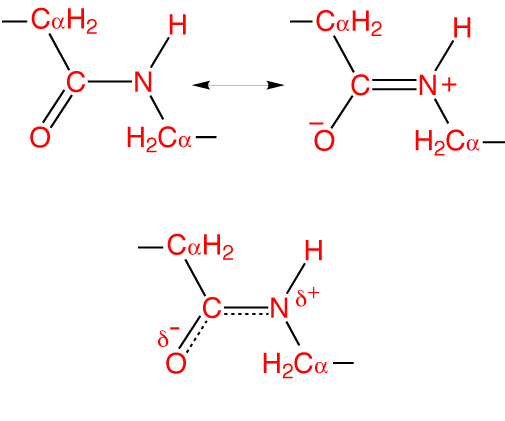
Ta cecha nazywana jest efektem rezonansu i wyjaśniona jest przez delokalizację wiązania kowalencyjnego między atomami węgla i azotu. W tym przypadku hybrydowe orbity sp2 tworzą chmurę elektronową propagującą się do atomu tlenu.
Tworzenie wiązania peptydowego
Tworzenie wiązania peptydowego jest typową reakcją polikondensacji, która jest termodynamicznie niekorzystna. W warunkach naturalnych równowaga jest przesunięta w kierunku wolnych aminokwasów, dlatego aby przeprowadzić syntezę, wymagany jest katalizator, który aktywuje lub modyfikuje grupę karboksylową dla łatwiejszego utrzymywania hydroksylu.
W żywej komórce tworzenie wiązania peptydowego zachodzi w centrum syntezy białek, gdzie specyficzne enzymy pracujące z energią wiązań makroergicznych działają jak katalizator.