Właściwości fizyczne i chemiczne węgla
Życie organiczne na Ziemi jest reprezentowane przez związki węgla. Pierwiastek ten jest częścią głównych składników struktur komórkowych: białek, węglowodanów i tłuszczów, a także stanowi podstawę substancji dziedziczności - kwasu dezoksyrybonukleinowego. W nieorganicznej naturze węgla jest jednym z najbardziej powszechnych elementów, które tworzą skorupę i atmosferę planety. Chemia organiczna jako dział chemii jest całkowicie poświęcona właściwościom pierwiastka chemicznego, węgla i jego związków. Nasz artykuł rozpatrzy fizykochemiczne właściwości węgla i właściwości jego właściwości.
Miejsce elementu w układzie okresowym
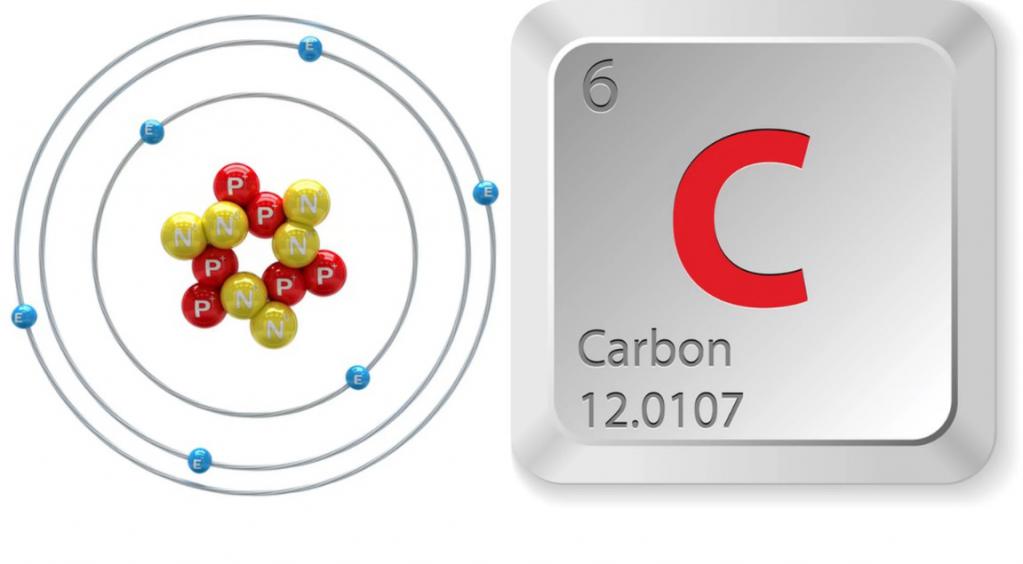
Podgrupa węgla jest główną podgrupą grupy IV, która oprócz węgla obejmuje również krzem, german, cynę i ołów. Wszystkie wymienione elementy mają taką samą strukturę zewnętrznego poziomu energii, na którym znajdują się cztery elektrony. Powoduje to podobieństwo ich właściwości chemicznych. W zwykłym stanie elementy podgrupy są dwuwartościowe, a gdy ich atomy ulegają wzbudzeniu, wykazują wartościowość równą 4. Fizyczne i chemiczne właściwości węgla zależą od stanu elektronicznych powłok jego atomu. Tak więc w reakcji z tlenem pierwiastek, którego cząstki znajdują się w stanie nieobecnym, tworzy obojętny tlenek CO. Atomy węgla w stanie wzbudzonym są utleniane do dwutlenku węgla, który wykazuje właściwości kwasowe.

Węgiel tworzy się w naturze
Diament, grafit i karbin to trzy alotropowe modyfikacje węgla jako prostej substancji. Przezroczyste kryształy o wysokim stopniu załamania promieni świetlnych, które są najtrudniejsze w przyrodzie, to diamenty. Słabo przewodzą ciepło i są dielektrykami. Sieć krystaliczna jest atomowa, bardzo trwała. W nim każdy atom pierwiastka jest otoczony czterema innymi cząstkami, tworząc regularny czworościan.
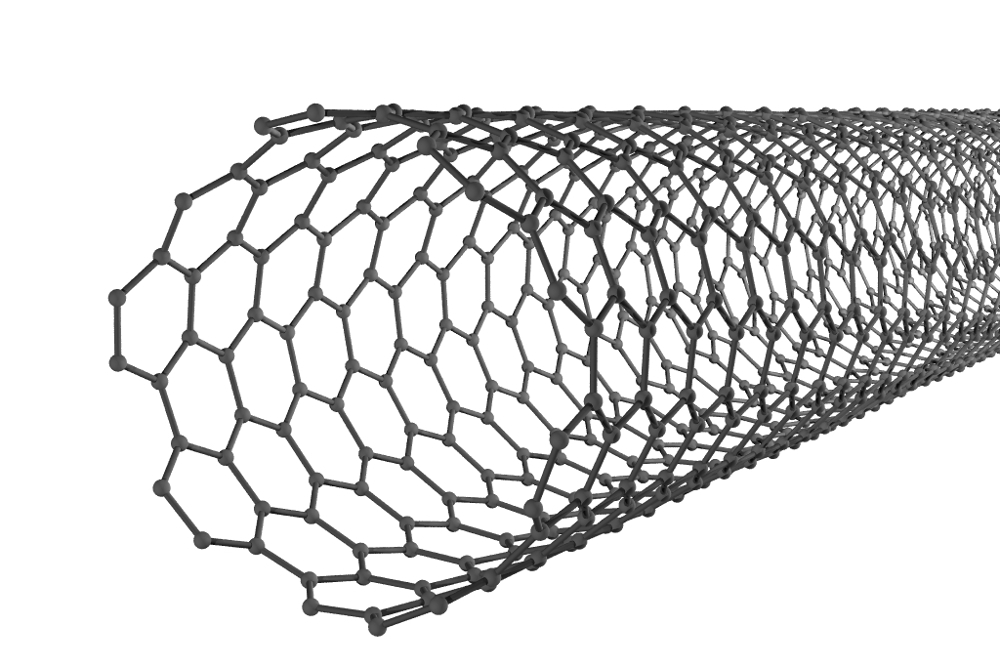
Całkowicie odmienne właściwości fizykochemiczne węgla, który tworzy grafit. Jest to tłusta, ciemnoszara substancja krystaliczna. Ma warstwową strukturę, odległości między warstwami atomów są dość duże, podczas gdy ich siły przyciągania są słabe. Dlatego, po wciśnięciu na pręt grafitowy, substancja dzieli się na cienkie łuski. Zostawiają na papierze ciemny ślad. Grafit przewodzi i jest nieco gorszy od metali w przewodnictwie elektrycznym.
Zdolność do przewodzenia prądu elektrycznego wyjaśnia struktura krystalicznej substancji. W nim cząstki węgla są związane z pozostałymi trzema przez silne kowalencyjne wiązania chemiczne. Czwarty elektron walencyjny każdego atomu pozostaje wolny i jest w stanie poruszać się w grubości substancji. Kierunek ruchu ujemnie naładowanych cząstek i powoduje pojawienie się prądu elektrycznego. Aplikacje graficzne są zróżnicowane. Wykorzystuje się go więc do produkcji elektrod w elektrotechnice i do prowadzenia procesu elektrolizy, za pomocą których uzyskują one na przykład metale alkaliczne w czystej postaci. Grafit znalazł zastosowanie w reaktory jądrowe kontrolować szybkość reakcji łańcuchowych zachodzących w nich jako moderator neutronów. Znane jest stosowanie substancji jako łupka lub smaru łupkowego w trących częściach mechanizmów.
Czym jest carbin?
Czarny krystaliczny proszek o szklistym połysku to Carbin. Został zsyntetyzowany w połowie XX wieku w Rosji. Substancja ma wyższą twardość niż grafit, jest chemicznie pasywna, ma właściwości półprzewodnika i jest najbardziej stabilną modyfikacją węgla. Związek jest trwalszy niż grafit. Istnieją również formy węgla, których właściwości chemiczne różnią się od siebie. Są to sadza, węgiel drzewny i koks.
Różne charakterystyki modyfikacji alotropowych węgla są wyjaśnione przez strukturę ich sieci krystalicznych. Jest to substancja ogniotrwała bez koloru i zapachu. Jest nierozpuszczalny w rozpuszczalnikach organicznych, ale jest zdolny do tworzenia stałych roztworów - stopów, na przykład z żelazem.
Właściwości chemiczne węgla
W zależności od substancji, z którą reaguje węgiel, może wykazywać podwójne właściwości: zarówno środek redukujący, jak i utleniacz. Na przykład, stapianie koksu z metalami, uzyskać ich związki - węgliki. Węglowodory powstają w reakcji z wodorem. Tak jest związki organiczne na przykład metan, etylen, acetylen, w których, podobnie jak w przypadku metali, węgiel ma stan utleniania równy -4. Reakcje chemiczne redukujące węgiel, którego właściwości badamy, przejawiają się podczas jego oddziaływania z tlenem, halogenami, wodą i podstawowe tlenki.
Tlenki węgla
Spalanie węgla w powietrzu o niskiej zawartości tlenu powoduje powstanie tlenku węgla, dwuwartościowego dwutlenku węgla. Jest bezbarwny, bezwonny i bardzo toksyczny. W połączeniu z hemoglobiną we krwi podczas oddychania, tlenek węgla rozprzestrzenia się w całym ludzkim ciele, powodując zatrucie, a następnie śmierć z uduszenia. W klasyfikacji substancja zastępuje obojętne tlenki, nie reaguje z wodą, nie odpowiada jej ani zasada, ani kwas. Właściwości chemiczne węgla o wartościowości 4 różnią się od poprzednio rozważanej charakterystyki.
Dwutlenek węgla
Bezbarwna substancja gazowa o temperaturze 15 ° C i ciśnieniu jednej atmosfery zamienia się w fazę stałą. Nazywa się suchy lód. Cząsteczki CO 2 są niepolarne, chociaż wiązanie kowalencyjne między atomami tlenu i węglem jest polarne. Połączenie odnosi się do tlenków kwasowych. Oddziałując z wodą, tworzy kwas węglanowy. Istnieją reakcje między dwutlenkiem węgla a substancjami prostymi: metalami i niemetalami, na przykład magnezem, wapniem lub koksem. W nich odgrywa rolę środka utleniającego.
Jakościowa reakcja na dwutlenek węgla
Aby upewnić się, że badanym gazem jest rzeczywiście tlenek węgla CO 2 , przeprowadza się następujący eksperyment w chemii nieorganicznej: substancję przepuszcza się przez klarowny roztwór wody wapiennej. Obserwacja zmętnienia roztworu z powodu wytrącania białego osadu węglanu wapnia potwierdza obecność cząsteczek dwutlenku węgla w mieszaninie odczynników. Po dalszym przejściu gazu przez roztwór wodorotlenku wapnia, osad CaCO3 rozpuszcza się z powodu jego konwersji do wodorowęglanu wapnia, soli rozpuszczalnej w wodzie.

Rola węgla w procesie domenowym
Właściwości chemiczne węgla stosowane są w przemysłowej produkcji żelaza z jego rud: rudy żelaza magnetycznego, rudego lub brązowego. Najważniejszym z nich będą właściwości redukujące węgiel i tlenki - tlenek węgla i tlenek węgla dwutlenek węgla. Procesy zachodzące w wielkim piecu można przedstawić następującą sekwencją reakcji:
- Po pierwsze, spala się koksu w strumieniu powietrza ogrzanym do 1850 ° C z wytworzeniem dwutlenku węgla: C + O2 = CO 2 .
- Przechodząc przez gorący węgiel, redukuje się do tlenku węgla: CO 2 + C = 2 CO.
- Tlenek węgla reaguje z rudą żelaza, tworząc tlenek żelaza: 3Fe2O3 + CO = 2Fe3O4 + CO2 ↑, Fe3O4 + CO = 3FeO + CO 2 .
- Reakcja otrzymywania żelaza będzie następująca: FeO + CO = Fe + CO 2
Stopione żelazo rozpuszcza w sobie mieszaninę węgla i tlenku węgla, okazuje się, substancja - cementyt.

Żelazo, wytopione w wielkim piecu, z wyjątkiem żelaza, zawiera do 4,5% węgla i innych zanieczyszczeń: manganu, fosforu, siarki. Stal, która różni się od żeliwa szeregiem cech, na przykład jego zdolność do zwijania i kutowania, ma w swoim składzie tylko 0,3 do 1,7% węgla. Wyroby stalowe są szeroko stosowane w prawie wszystkich branżach: inżynierii mechanicznej, metalurgii, medycynie.
W naszym artykule dowiedzieliśmy się, jakie właściwości chemiczne węgla i jego związków znajdują zastosowanie w różnych sferach ludzkiej działalności.