Wtórna struktura białka i jego przestrzenna organizacja. Powstawanie drugorzędowej struktury białka.
W organizmie rola białek jest niezwykle duża. Jednocześnie taką nazwę można nosić dopiero po uzyskaniu wcześniej ustalonej struktury. Do tego momentu jest to polipeptyd, tylko łańcuch aminokwasowy, który nie może spełniać swoich nieodłącznych funkcji. Ogólnie rzecz biorąc, przestrzenna struktura białek (pierwotna, wtórna, trzeciorzędowa i domena) jest ich strukturą trójwymiarową. I najważniejsze dla ciała struktury drugorzędne, trzeciorzędne i domenowe.
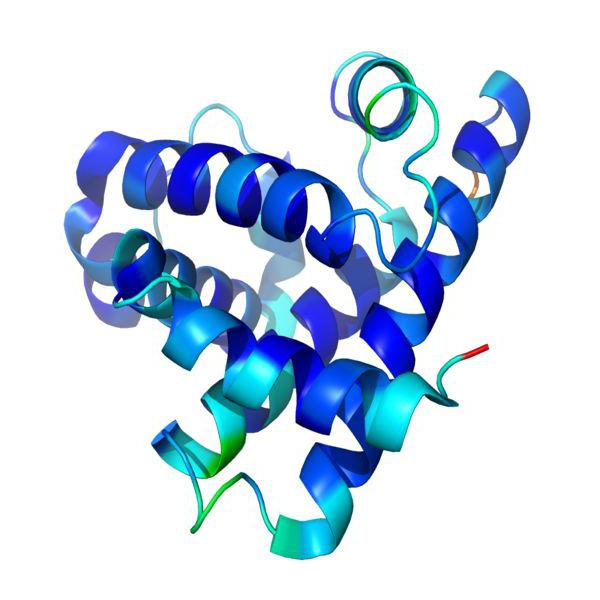
Wymagania wstępne do badania struktury białka
Wśród metod badania struktury chemikaliów szczególną rolę odgrywa krystalografia rentgenowska. Za jego pośrednictwem można uzyskać informacje o sekwencji atomów w związkach molekularnych i ich przestrzennej organizacji. Po prostu, zdjęcie rentgenowskie można wykonać dla pojedynczej molekuły, która stała się możliwa w latach 30. XX wieku.
To wtedy naukowcy odkryli, że wiele białek ma nie tylko liniową strukturę, ale może być również ułożone w spirale, sploty i domeny. W wyniku przeprowadzenia wielu eksperymentów naukowych okazało się, że struktura drugorzędowa białka jest ostateczną postacią dla białek strukturalnych i związku pośredniego dla enzymów i immunoglobulin. Oznacza to, że substancje, które ostatecznie mają strukturę trzeciorzędową lub czwartorzędową, na etapie ich "dojrzewania" muszą również przejść etap formowania spiralnego, charakterystyczny dla struktury drugorzędowej.
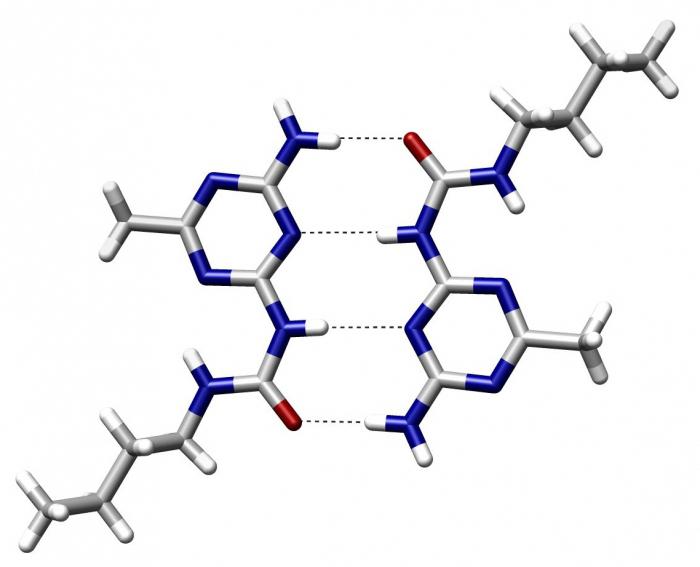
Tworzenie drugorzędowej struktury białkowej
Jak tylko synteza polipeptydu na rybosomach zostanie zakończona w zgrubnej sieci endoplazmy komórkowej, struktura białka. Sam polipeptyd jest długotrwałą cząsteczką, która zajmuje dużo miejsca i jest niewygodna do transportu i wykonywania nieodłącznych funkcji. Dlatego, aby zmniejszyć jego rozmiar i nadać mu specjalne właściwości, rozwija się struktura drugorzędna. Dzieje się tak poprzez tworzenie alfa-helis i warstw beta. W ten sposób uzyskuje się białko o strukturze drugorzędowej, które w przyszłości zamieni się w trzeciorzędowe i czwartorzędowe lub będzie używane w tej postaci.
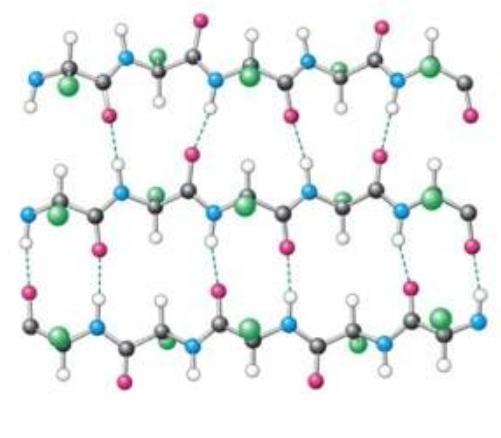
Organizacja wtórna
Jak wykazały liczne badania, struktura drugorzędowa białka jest albo helisą alfa, albo warstwą beta, albo naprzemiennością sekcji z tymi pierwiastkami. Co więcej, struktura wtórna jest sposobem skręcania i tworzenia spirali cząsteczki białka. Jest to chaotyczny proces, który zachodzi z powodu wiązań wodorowych występujących między polarnymi regionami reszt aminokwasowych w polipeptydzie.
Struktura pomocnicza helisy alfa
Ponieważ tylko L-aminokwasy biorą udział w biosyntezie polipeptydów, tworzenie drugorzędowej struktury białka rozpoczyna się od skrętu w kierunku zgodnym z ruchem wskazówek zegara (skręt w prawo). Dla każdego skrętu spiralnego jest dokładnie 3,6 reszt aminokwasowych, a odległość wzdłuż osi spiralnej wynosi 0,54 nm. Są to typowe właściwości drugorzędowej struktury białka, które nie zależą od rodzaju aminokwasów biorących udział w syntezie.
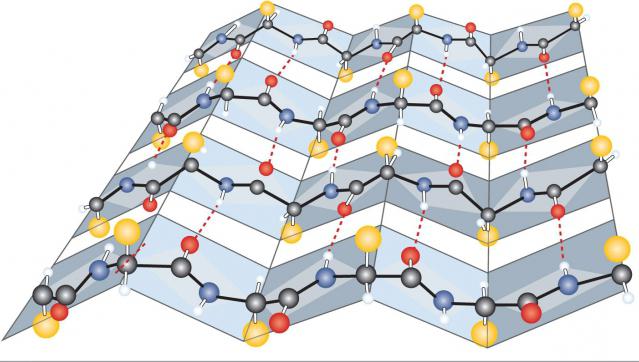
Stwierdzono, że nie cały łańcuch polipeptydowy jest całkowicie spiralny. Jego struktura zawiera sekcje liniowe. W szczególności cząsteczka białka pepsyny jest spiralna tylko o 30%, lizozym o 42% i hemoglobina o 75%. Oznacza to, że struktura drugorzędowa białka nie jest ściśle spiralna, ale kombinacja jego sekcji z liniowymi lub warstwowymi.
Struktura wtórna warstwy beta
Drugim typem organizacji strukturalnej substancji jest warstwa beta, która składa się z dwóch lub więcej nici polipeptydu połączonego wiązaniem wodorowym. Ta ostatnia występuje pomiędzy wolnymi grupami CO NH2. W związku z tym białka strukturalne (mięśniowe) są głównie połączone.
Struktura białek tego typu jest następująca: jedna nić polipeptydu z określeniem końcowych części A-B jest równoległa do drugiej. Jedynym zastrzeżeniem jest to, że druga cząsteczka jest usytuowana przeciwrównolegle i jest oznaczona jako BA. W ten sposób tworzy się warstwa beta, która może składać się z dowolnej liczby łańcuchów polipeptydowych, połączonych wieloma wiązaniami wodorowymi.
Wiązanie wodorowe
Wtórna struktura białka jest wiązaniem opartym na wielu polarnych interakcjach atomów o różnych wskaźnikach elektroujemności. 4 pierwiastki mają największą zdolność do tworzenia takiego wiązania: fluor, tlen, azot i wodór. W białkach jest wszystko oprócz fluoru. W związku z tym można utworzyć i utworzyć wiązanie wodorowe, dając możliwość połączenia łańcuchów polipeptydowych w warstwach beta i helisie alfa.
Najprostszym sposobem wyjaśnienia występowania wiązań wodorowych jest woda, która jest dipolem. Tlen ma silny ładunek ujemny, a ze względu na wysoką polaryzację wiązania O-H, wodór uważa się za dodatni. W tym stanie cząsteczki są obecne w pewnym środowisku. I wielu z nich dotyka i zderzają się. Wtedy tlen z pierwszej cząsteczki wody przyciąga wodór z drugiej. I tak na łańcuchu.
Podobne procesy zachodzą w białkach: elektroujemny tlen wiązania peptydowego przyciąga wodór z dowolnej części innej reszty aminokwasowej, tworząc wiązanie wodorowe. Jest to słaba koniugacja biegunowa, ponieważ jej rozbicie wymaga wydania około 6,3 kJ energii.
Dla porównania, najsłabiej wiązanie kowalencyjne białko wymaga 84 kJ energii w celu jej rozbicia. Najsilniejsze wiązanie kowalencyjne będzie wymagało 8400 kJ. Jednak ilość wiązań wodorowych w cząsteczce białka jest tak duża, że ich całkowita energia pozwala cząsteczce na istnienie w agresywnych warunkach i utrzymanie jej przestrzennej struktury. Z tego powodu istnieją białka. Struktura białek tego typu zapewnia siłę niezbędną do funkcjonowania mięśni, kości i więzadeł. Ogromne znaczenie ma struktura drugorzędowa białek dla organizmu.