Benzen: wzór. Benzen: struktura elektronowa, właściwości
Węglowodory aromatyczne są ważną częścią cyklicznej serii związki organiczne. Najprostszym przedstawicielem takich węglowodorów jest benzen. Formuła tej substancji odróżniała ją nie tylko od szeregu innych węglowodorów, ale także nadała impuls rozwojowi nowego kierunku w chemii organicznej.
Odkrycie aromatycznych węglowodorów
Węglowodory aromatyczne odkryto na początku XIX wieku. W tamtych czasach najczęściej używanym paliwem do oświetlenia ulic był gaz świetlny. Ze swojego kondensatu, wielki angielski fizyk Michael Faraday w 1825 roku wyróżnił trzy gramy substancji oleistej, opisał szczegółowo jego właściwości i nazwał go nawęglonym wodorem. W 1834 r. Niemiecki naukowiec, chemik Mitscherlich, ogrzewający kwas benzoesowy z wapnem, uzyskał benzen. Wzór, według którego przebiegła ta reakcja, pokazano poniżej:
C6H5 COOH + CaO fuzja C6H6 + CaCO3.
W tym czasie uzyskano rzadki kwas benzoesowy z żywicy benzoesowej, którą mogą uwolnić niektóre rośliny tropikalne. W 1845 r. Znaleziono nowy związek w smole węglowej, który był dość przystępnym surowcem do otrzymywania nowej substancji na skalę przemysłową. Kolejnym źródłem benzenu jest ropa produkowana na niektórych polach. Aby sprostać przemysłowym potrzebom benzenu, wytwarza się go również poprzez aromatyzację niektórych grup acyklicznych węglowodorów ropopochodnych.
Nowoczesna wersja nazwy sugerowana przez niemieckiego naukowca Liebiga. Źródła słowa "benzen" należy szukać w językach arabskich - tam jest tłumaczone jako "kadzidło".
Właściwości fizyczne benzenu
Benzen jest bezbarwną cieczą o specyficznym zapachu. Substancja ta wrze w temperaturze 80,1 o C, twardnieje w temperaturze 5,5 o C i zamienia się w biały krystaliczny proszek. Benzen praktycznie nie przewodzi ciepła i elektryczności, jest słabo rozpuszczalny w wodzie i dobrze - w różnych olejach. Właściwości aromatyczne benzenu odzwierciedlają istotę struktury jego wewnętrznej struktury: względnie trwały rdzeń benzenowy i nieokreślony skład.
Klasyfikacja chemiczna benzenu

Benzen i jego homologi - toluen i etylobenzen - są aromatyczną serią cyklicznych węglowodorów. Struktura każdej z tych substancji zawiera wspólną strukturę zwaną pierścieniem benzenowym. Struktura każdej z powyższych substancji zawiera specjalne cykliczne ugrupowanie utworzone przez sześć atomów węgla. Nazywa się to aromatycznym pierścieniem benzenowym.
Historia odnajdywania
Ustanowienie wewnętrznej struktury benzenu rozciągnęło się na kilka dziesięcioleci. Podstawowe zasady struktury (model pierścieniowy) zaproponował w 1865 r. Chemik A. Kekule. Jak głosi legenda, niemiecki naukowiec zobaczył wzór tego elementu we śnie. Później zaproponowano uproszczenie zapisu struktury substancji, tzw. Benzen. Formuła dla tej substancji to sześciokąt. Symbole węgla i wodoru, które powinny znajdować się w rogach sześciokąta, są pomijane. Tak więc okazuje się to proste regularny sześciokąt z naprzemiennymi pojedynczymi i podwójnymi liniami po bokach. Ogólną formułę benzenu pokazano na poniższym rysunku. 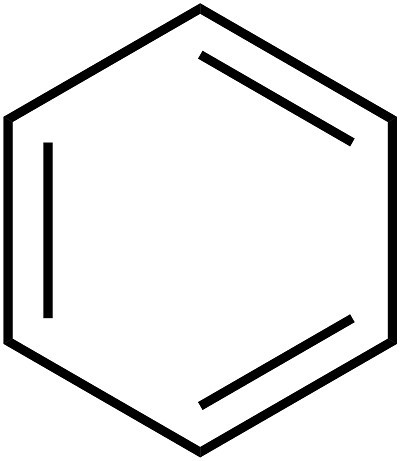
Aromatyczne węglowodory i benzen
Wzór chemiczny tego pierwiastka sugeruje, że reakcje addycji są nietypowe dla benzenu. Dla tego, podobnie jak dla innych pierwiastków aromatycznych, typowe są reakcje podstawienia atomów wodoru w pierścieniu benzenowym.
Reakcja sulfonowania
Zapewniając skoncentrowanie interakcji kwas siarkowy i benzen, podnosząc temperaturę reakcji, można otrzymać kwas benzosulfonowy i wodę. Wzór strukturalny benzenu w tej reakcji jest następujący: 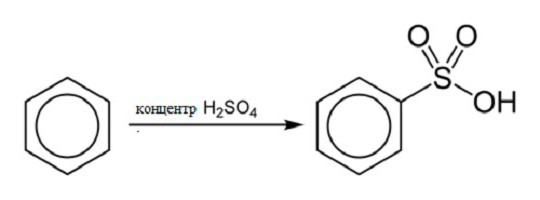
Reakcja halogenowania
Brom lub chrom w obecności katalizatora reaguje z benzenem. Powoduje to wytwarzanie pochodnych halogenowych. Ale reakcja nitrowania odbywa się za pomocą stężonego kwas azotowy. Końcowym wynikiem reakcji jest związek azotu:
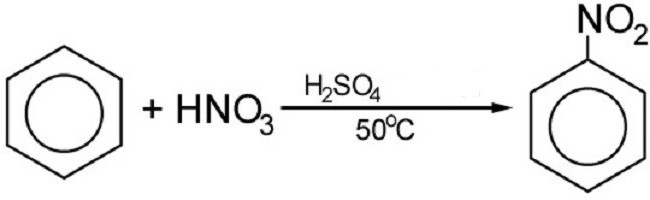
Za pomocą azotowania otrzymuje się materiał wybuchowy znany wszystkim - trotyl lub trinitotoluen. Niewiele osób wie, że benzen jest podstawą toli. Wiele innych związków nitrowych na bazie pierścienia benzenowego można również stosować jako materiały wybuchowe.
Elektroniczna formuła benzenu
Standardowa formuła pierścienia benzenowego nie odzwierciedla dokładnie wewnętrznej struktury benzenu. Zgodnie z tym, benzen musi mieć trzy zlokalizowane wiązania p, z których każdy musi oddziaływać z dwoma atomami węgla. Ale jak pokazuje doświadczenie, benzen nie ma zwykłych wiązań podwójnych. Wzór cząsteczkowy benzenu pozwala zobaczyć, że wszystkie wiązania w pierścieniu benzenowym są równoważne. Każda z nich ma długość około 0,140 nm, która jest wartością pośrednią między długością standardowego wiązania prostego (0,154 nm) i podwójnego wiązania etylenu (0,134 nm). Wzór strukturalny benzenu, przedstawiony naprzemiennie, jest niedoskonały. Bardziej wiarygodny trójwymiarowy model benzenu, który wygląda tak, jak pokazano na poniższym obrazku. 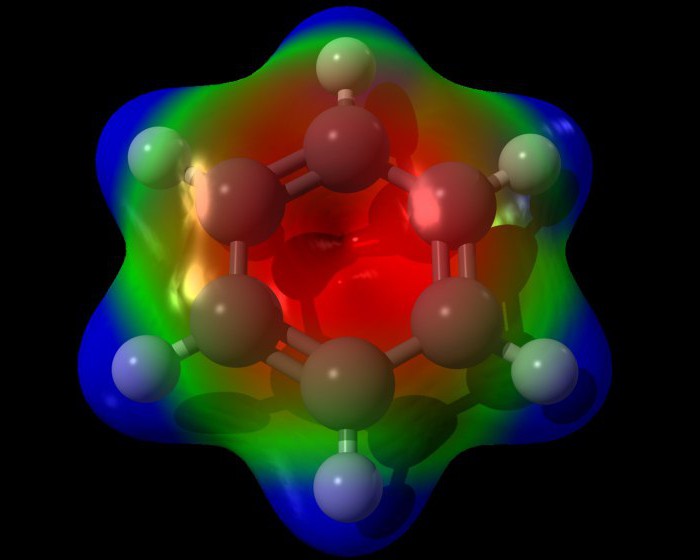 Każdy z atomów pierścienia benzenowego znajduje się w stanie hybrydyzacji sp2. Wydaje na tworzenie wiązań sigma na trzech elektronach walencyjnych. Te elektrony obejmują dwa sąsiednie atomy węglowodanu i jeden atom wodoru. W tym przypadku zarówno elektrony, jak i wiązania C-C, H-H znajdują się w tej samej płaszczyźnie.
Każdy z atomów pierścienia benzenowego znajduje się w stanie hybrydyzacji sp2. Wydaje na tworzenie wiązań sigma na trzech elektronach walencyjnych. Te elektrony obejmują dwa sąsiednie atomy węglowodanu i jeden atom wodoru. W tym przypadku zarówno elektrony, jak i wiązania C-C, H-H znajdują się w tej samej płaszczyźnie.
Czwarty elektron walencyjny tworzy chmurę w postaci wolumetrycznej ósemki, usytuowanej prostopadle do płaszczyzny pierścienia benzenowego. Każda taka chmura elektronowa zachodzi ponad płaszczyznę pierścienia benzenowego i bezpośrednio pod nią z chmurami dwóch sąsiednich atomów węgla.
Gęstość obłoków p-elektronów tej substancji rozkłada się równomiernie pomiędzy wszystkie wiązania węglowe. W ten sposób powstaje jedna pierścieniowa chmura elektronowa. W ogólnej chemii struktura ta nazywana jest aromatycznym elektronicznym sekstetem.
Równa wartość wewnętrznych wiązań benzenu
Właśnie równoważność wszystkich powierzchni sześciokąta wyjaśnia równość wiązań aromatycznych, które powodują charakterystyczne właściwości chemiczne i fizyczne benzenu. Wzór na równomierny rozkład chmury p-elektronowej i równoważność wszystkich jej połączeń wewnętrznych przedstawiono poniżej.
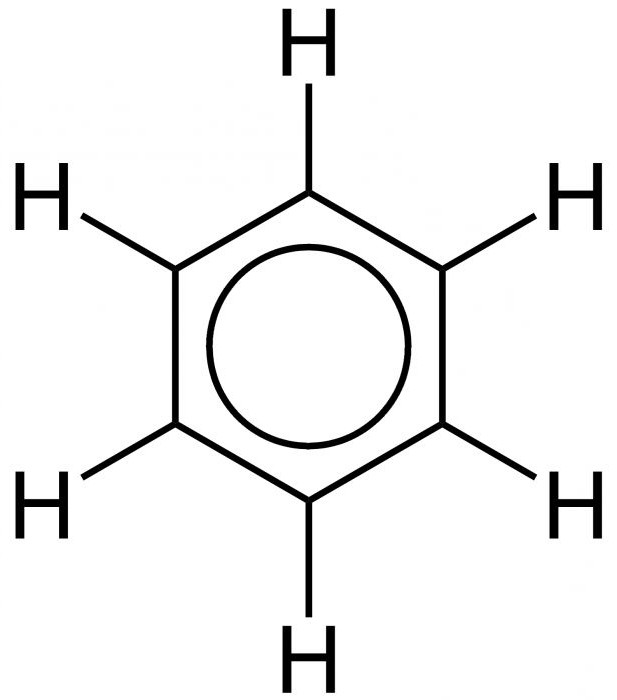
Jak można zauważyć, zamiast naprzemiennych pojedynczych i podwójnych cech, wewnętrzna struktura jest przedstawiona jako okrąg.
Istota wewnętrznej struktury benzenu daje klucz do zrozumienia wewnętrznej struktury cyklicznych węglowodorów i rozszerza możliwości praktycznego zastosowania tych substancji.