Masa cząsteczkowa: podstawowe zasady definicji
Masa cząsteczkowa jest jedną z podstawowych koncepcji współczesnej chemii. Jego wprowadzenie stało się możliwe po naukowym potwierdzeniu twierdzenia Avogadro, że wiele substancji składa się z maleńkich cząsteczek - cząsteczek, z których każda z kolei składa się z atomów. Nauka zawdzięcza ten osąd włoskiemu chemikowi Amadeo Avogadro, kto naukowo uzasadniony struktura molekularna Substancje i chemia dały wiele ważnych pojęć i praw.

Jednostki masy pierwiastków
Początkowo atom wodoru uznano za najlżejszy pierwiastek we Wszechświecie jako podstawową jednostkę masy atomowej i molekularnej. Ale większość mas atomowych została obliczona na podstawie ich związków tlenu, więc zdecydowano się wybrać nowy standard w celu określenia mas atomowych. Założono, że masa atomowa tlenu wynosi 15, masa atomowa najlżejszej substancji na Ziemi, wodór wynosi 1. W 1961 r. Układ tlenowy do oznaczania ciężaru był powszechny, ale stwarzał pewne niedogodności.
Ad
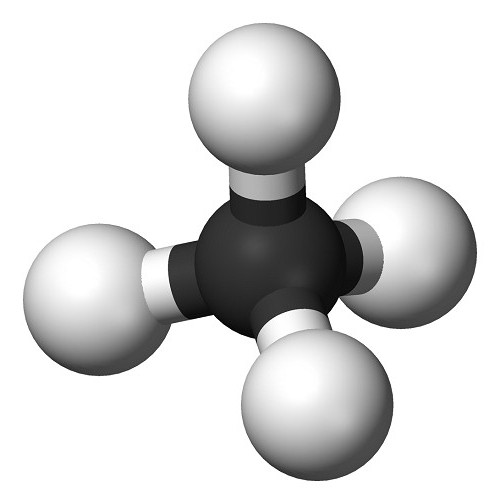
W 1961 r. Przyjęto nową skalę. względne masy atomowe Odniesieniem dla którego był izotop węgla 12 C. Jednostka masy atomowej (w skrócie Amu) stanowi 1/12 masy tego wzorca. Obecnie masa atomowa jest masą atomu, która powinna być wyrażona w amu.
Masa cząsteczek
Masa cząsteczki dowolnej substancji jest równa sumie mas wszystkich atomów tworzących daną cząsteczkę. Najlżejsza masa cząsteczkowa gazu jest w wodorze, jego związek jest zapisany jako H2 i ma wartość zbliżoną do dwóch. Cząsteczka wody składa się z atomu tlenu i dwóch atomów wodoru. Oznacza to, że jego masa cząsteczkowa wynosi 15,994 + 2 * 1,0079 = 18,0152 amu. Największe masy cząsteczkowe mają złożone związki organiczne - białka i aminokwasy. Masa cząsteczkowa jednostki strukturalnej białka wynosi od 600 do 10 6 i więcej, w zależności od liczby łańcuchów peptydowych w tej makrocząsteczkowej strukturze. 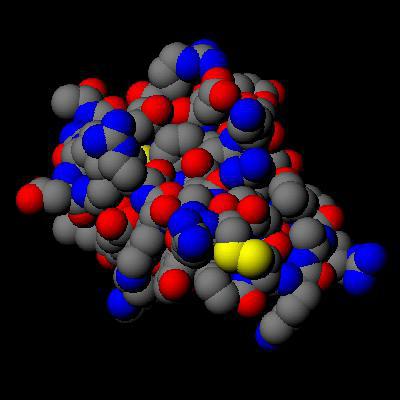
Moth
W tym samym czasie ze standardowymi jednostkami masy i objętości, w systemie chemicznym wykorzystywana jest specjalna jednostka systemowa, mol.
Mole to ilość substancji, która zawiera tyle jednostek strukturalnych (jonów, atomów, cząsteczek, elektronów), tyle jest zawarte w 12 gramach izotopu 12 C.
Przy stosowaniu miary ilości substancji konieczne jest wskazanie, które jednostki strukturalne mają oznaczać. Jak wynika z pojęcia "mol", w każdym pojedynczym przypadku powinien on dokładnie wskazywać, do których jednostek strukturalnych się odnoszą - na przykład, mol jonów H + , mol cząsteczek H 2 i tak dalej.
Ad
Molowa i masa cząsteczkowa
Masę substancji w 1 mol mierzy się wg / mol i nazywa się masa molowa. Związek między masą cząsteczkową a molową można zapisać jako równanie.
ν = k × m / M, gdzie k jest współczynnikiem proporcjonalności.
Łatwo powiedzieć, że dla każdego współczynnika współczynnik proporcjonalności będzie równy jeden. Rzeczywiście, izotop węgla ma względną masę cząsteczkową równą 12 AU.m i z definicji masa molowa tej substancji wynosi 12 g / mol. Stosunek masy cząsteczkowej do molowej wynosi 1. Stąd można wywnioskować, że masa cząsteczkowa i masa cząsteczkowa mają te same wartości liczbowe.
Objętości gazu
Jak wiadomo, wszystkie substancje wokół nas mogą mieć stały, ciekły lub gazowy stan skupienia. W przypadku ciał stałych najczęściej stosowaną miarą podstawową jest masa, dla ciał stałych i cieczy, objętość. Wynika to z faktu, że ciała stałe zachowują swój kształt i ostateczne wymiary. Substancje ciekłe i gazowe nie mają skończonych rozmiarów. Cechą każdego gazu jest to, że odległość między jego jednostkami strukturalnymi - cząsteczkami, atomami, jonami - jest wielokrotnie większa niż te same odległości w cieczach lub ciałach stałych. Na przykład jeden mol wody w normalnych warunkach zajmuje objętość 18 ml - w przybliżeniu taki sam rozmiar mieści się w jednej łyżce stołowej. Objętość jednego mola drobnej soli krystalicznej wynosi 58,5 ml, a objętość 1 mola cukru to 20 razy więcej moli wody. W przypadku gazów wymagana jest większa przestrzeń. Jeden mol azotu w normalnych warunkach zajmuje objętość 1,240 razy więcej niż jeden mol wody. 
Zatem objętości substancji gazowych znacznie różnią się od objętości cieczy i ciała stałego. Wynika to z różnicy odległości między cząsteczkami substancji w różnych stanach agregacji.
Normalne warunki
Stan dowolnego gazu zależy w dużej mierze od temperatury i ciśnienia. Na przykład azot w temperaturze 20 ° C zajmuje objętość 24 litrów, aw temperaturze 100 ° C przy tym samym ciśnieniu - 30,6 litra. Chemicy wzięli pod uwagę tę zależność, dlatego postanowiono ograniczyć wszystkie operacje i pomiary za pomocą substancji gazowych do normalnych warunków. Na całym świecie parametry normalnych warunków są takie same. W przypadku chemikaliów gazowych są to:
Ad
- Temperatura w 0 ° C
- Ciśnienie 101,3 kPa.
W normalnych warunkach akceptowany jest specjalny skrót - n. Czasami ta notacja nie jest zapisana w zadaniach, wtedy należy uważnie przeczytać warunki problemu i doprowadzić podane parametry gazu do normalnych warunków.
Oblicz objętość 1 mola gazu
Na przykład łatwo obliczyć jeden mol dowolnego gazu, na przykład azotu. Aby to zrobić, najpierw musisz znaleźć wartość jego względnej masy cząsteczkowej:
M r (N 2 ) = 2 x 14 = 28.
Ponieważ względna masa cząsteczkowa substancji jest liczbowo równa molarnej, wówczas M (N2) = 28 g / mol.
Eksperymentalnie stwierdzono, że w normalnych warunkach gęstość azotu wynosi 1,25 g / litr.
Zastępujemy tę wartość w standardowej formule znanej z szkolnego kursu fizyki, gdzie:
- V oznacza objętość gazu;
- m jest masą gazu;
- ρ jest gęstością gazu.
Otrzymujemy molową objętość azotu w normalnych warunkach
V (N2) = 25 g / mol: 1,25 g / litr = 22,4 l / mol.
Okazuje się, że jeden mol azotu zajmuje 22,4 litra.
Jeśli wykonasz taką operację ze wszystkimi istniejącymi substancjami gazowymi, możesz dojść do zaskakującego wniosku: objętość dowolnego gazu w normalnych warunkach wynosi 22,4 litra. Bez względu na to, który gaz jest zaangażowany, jaka jest jego struktura i właściwości fizyko-chemiczne, jeden mol tego gazu zajmie objętość 22,4 litra.
Ad

Molowa objętość gazu jest jednym z najważniejszych stałych w chemii. Ta stała pozwala rozwiązać wiele problemów chemicznych związanych z mierzeniem właściwości gazów w normalnych warunkach.
Wyniki
Masa cząsteczkowa substancji gazowych jest ważna dla określenia ilości substancji. A jeśli badacz zna ilość substancji w postaci gazu, może określić masę lub objętość takiego gazu. Dla tej samej części substancji gazowej spełnione są jednocześnie następujące warunki:
ν = m / M ν = V / V m.
Jeśli usuniemy stałą ν, możemy wyrównać te dwa wyrażenia:
m / M = V / V m.
Dzięki temu można obliczyć masę jednej porcji substancji i jej objętość, a także uzyskać znaną masę cząsteczkową badanej substancji. Korzystając z tego wzoru, można łatwo obliczyć stosunek objętości do masy. Podczas odlewania tego wzoru do postaci M = mV m / V, znana będzie masa molowa pożądanego związku. Aby obliczyć tę wartość, wystarczy znać masę i objętość badanego gazu.
Należy pamiętać, że ścisła zgodność rzeczywistej masy cząsteczkowej substancji z tą znalezioną wzorem jest niemożliwa. Każdy gaz zawiera masę zanieczyszczeń i dodatków, które powodują pewne zmiany w jego strukturze i wpływają na określenie jego masy. Ale te wahania powodują zmiany w trzeciej lub czwartej cyfrze po przecinku w uzyskanym wyniku. Dlatego w przypadku problemów szkolnych i eksperymentów znalezione wyniki są dość wiarygodne.