Potencjał redoks: obliczanie i pomiar
Potencjał redoks (ORP) jest parametrem opisującym poziom utlenienia (utlenianie) i redukcję substancji. Innymi słowy, jest to zdolność do oddawania lub odbierania elektronów w wyniku interakcji pierwiastków chemicznych, w zależności od charakteru procesów i warunków reakcji.

Krótki opis
Potencjał redoks - pojęcie w większym stopniu odzwierciedlające zdolność niż udział (aktywność). Potencjał energetyczny to energia, która gromadzi się i jest gotowa do użycia w dowolnym momencie. W momencie, w którym zostaną wykorzystane wszystkie związki chemiczne, które mogą być poddane utlenianiu i redukcji, układ dochodzi do stanu równowagi. Najczęściej w takich przypadkach pozostaje pewna nadwyżka energii, która tworzy potencjał redukcji lub utleniania roztworu.
Tworzenie się rdzy jest typowym przykładem procesu utleniania / redukcji. Elementy biorące udział w tym procesie ulegają przemianom chemicznym. Tlen łączy się z żelazem, tworząc tlenek żelaza (lepiej znany jako rdza): żelazo ulega utlenieniu, a tlen ulega redukcji. W wyniku tego potencjał redox układu "Fe / O 2 " staje się równowagowy.

Woda ORP
Czysta woda pitna jest bardzo ważnym czynnikiem w życiu, o którym często się zapomina. Niestety, istnieje bardzo niewiele absolutnie czystych źródeł pitnej życiodajnej wody, produkowanych na skalę przemysłową, aby zapewnić ludzkie osiedla. Dlatego woda wchodząca do systemu zaopatrzenia w wodę musi być oczyszczona i zdezynfekowana. Jak się okazało, możesz użyć właściwości ORP.
Potencjał redox wody mierzy się w miniwoltach (mV). Ten parametr wskazuje na aktywność środków dezynfekujących, a nie na stężenie wyrażone w ppm. Związki chemiczne - chlor, brom, nadtlenek wodoru, kwas nadoctowy lub ozon - są wysoce skutecznymi środkami utleniającymi (ale nie zawsze bezpiecznymi).
Są zdolne do utleniania ("wybierania") elektronów z innych związków chemicznych, a zatem są doskonałymi środkami dezynfekcyjnymi. Poprzez powodowanie zmian w stanie chemicznym drobnoustrojów chorobotwórczych, szkodliwych glonów i innych substancji organicznych, środek dezynfekujący je zabija. W praktyce oznacza to, że odkażona woda o odpowiednim poziomie pH może nie tylko niszczyć szkodliwe bakterie, ale również samoczyścić się z nich.
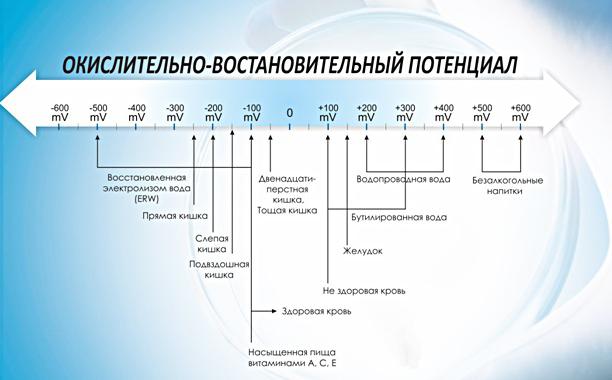
Normy bezpieczeństwa
W 1972 r. Światowa Organizacja Zdrowia (WHO) w rozporządzeniach dotyczących norm dotyczących wody pitnej odkryła, że przy AFP 650 mV woda jest uważana za dezynfekowaną, a dezaktywacja wirusów zachodzi niemal natychmiast. Badania wykazały, że jeśli potencjał redox wynosi 650 mV, bakterie E. coli są niszczone natychmiast lub w ciągu kilku sekund. Aby zniszczyć bardziej oporne mikroorganizmy, takie jak Listeria, Salmonella, drożdże i grzyby, konieczne jest, aby ORP wynosił 750 mV lub więcej.
Jak mierzyć ORP
W praktyce pomiar potencjału redoks odbywa się za pomocą specjalnych urządzeń. Zasada działania urządzenia rejestrującego ORP opiera się na pomiarze napięcia (w miniwoltach, mV) w obwodzie elektrycznym utworzonym przez srebrną elektrodę (biegun ujemny) i elektrodę platynową (biegun dodatni). Można również stosować inne materiały, takie jak grafit i węgiel szklisty. Elektrody urządzenia są umieszczane w roztworze wodnym, a następnie pobierane są odczyty.
Mierzone jest bardzo małe napięcie (mV), które powstaje, gdy metal zostaje umieszczony w wodzie zawierającej substancje utleniające i redukujące. Te wartości naprężenia charakteryzują potencjał utleniaczy zawartych w cieczy.

Możliwe ograniczenia
Nie jest możliwe dokładne zmierzenie standardowego potencjału redoks, dlatego w praktyce wartość ORP badanej pary redoks jest mierzona w stosunku do każdej standardowej połowy reakcji porównawczej i utworzonej na jej podstawie elektrody (elektrody odniesienia). Standardowa reakcja połówkowa musi być odwracalna, a elektroda odniesienia musi mieć stały i odtwarzalny potencjał oraz mieć dość prostą strukturę.
Elektrody Redox
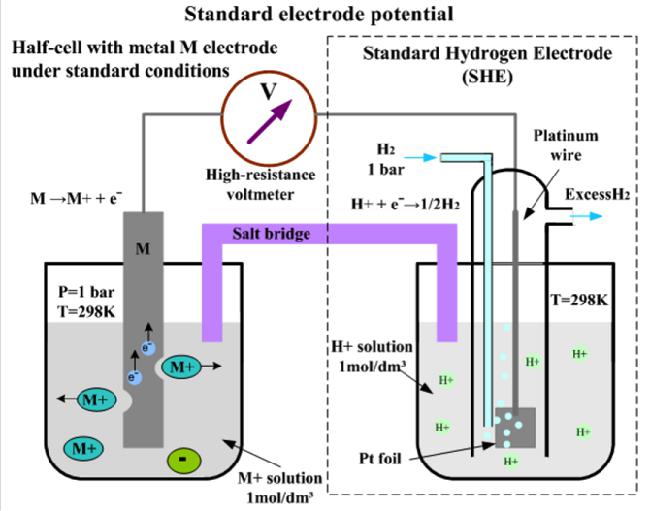
Standardowa elektroda wodorowa składająca się z platynowej taśmy pokrytej warstwą drobnej platyny (platynowej czerni) i zanurzonej w roztworze soli jest przyjmowana przez społeczność naukową jako uniwersalna elektroda odniesienia do pomiaru ORP. (kwas siarkowy) z aktywnością pierwiastka chemicznego jony wodoru, równe jedności: a H + = 1 .
Platynę przemywa się gazowym wodorem pod ciśnieniem 101,3 kPa (lub 1 atm), który jest sorbowany na porowatej powierzchni platynowej czerni. Oznaczone przez standardową elektrodę wodorową: Pt (H 2 ) (p = 1 atm) HCl (a H + = 1) .
Na powierzchni takiej odwracalnie działającej elektrody zachodzi reakcja połówkowa: 2 N + + 2 ↔ ↔ ¼ 2 ↑ . Potencjał, który jest konwencjonalnie akceptowany w zera w dowolnej temperaturze: E z SHE = 0 . Należy zauważyć, że SHE nie jest elektrodą redoks, ale odnosi się do tak zwanych elektrod pierwszego rodzaju. Ich potencjał zależy od aktywności niektórych kationów - w pokazanym przykładzie, od aktywności kationów wodoru.
Reakcje redoks
IAD nazywa się reakcją ze zmianą stopnia utlenienia reagujących substancji. Z tą zmianą stany utleniania występuje z przyczepieniem / uwalnianiem elektronów. Procesy dodawania i odrzutu elektronów są uważane przez naukowców za połowiczne reakcje redukcji i utleniania, odpowiednio:
- aOK 1 + ne В sOc 1 (odzysk);
- bBoc 2 - ne ↔ dOk 2 (utlenianie).
W każdej połowie reakcji pierwiastek o wyższym stopniu utlenienia nazywany jest formą utlenioną (OK), a w niższym stopniu utleniania - formą zredukowaną (Boc). Utlenione / zredukowane postacie substancji to sprzężona para redoks nazywana parą redoks. W grupie redoks, forma utleniona (OK) jest akceptorem elektronów, forma zredukowana (Boc) jest rodzajem donora elektronów. Reakcje połowiczne / utlenianie nie są możliwe oddzielnie - jeśli obecny jest donor elektronów, musi być obecny również akceptor.
Standardowy ORP
Jeżeli potencjał badanej pary redoks jest mierzony w standardowych warunkach, temperatura wynosi 25 ᵒ С (298 K), ciśnienie wynosi 1 atm (101,3 kPa), a aktywność utlenionych i zredukowanych form jest równa 1 ( ok = słońce = 1 mol / l ) nazywane jest "standardowym potencjałem redoks" i jest oznaczane jako: E 0 approx / Vos .
Potencjalna tabela
Standardowe zestawy potencjałów redoks par redoks przez naukowców mierzone w praktyce. Ich wartości w woltach są wyświetlane przez tabelę potencjałów redox:
Para OB (OK / VOS) | E 0 Ok / Vos | Para OB (OK / VOS) | E 0 Ok / Vos |
2H + / H 2 | 0,00 | F 2 / 2F - | +2,28 |
S 0 / H 2 S | -0,14 | MnO 4 - / Mn 2+ | +1.51 |
Fe 2+ / Fe 0 | -0,47 | Cl 2 / 2Cl - | +1.36 |
Zn 2+ / Zn 0 | -0,76 | Fe 3+ / Fe 2+ | +0,77 |
Al 3+ / Al 0 | -1.61 | I 2 / 2I - | +0,54 |
Mg 2+ / Mg 0 | -2.07 | Sn 4+ / Sn 2+ | +0,15 |
Dekodowanie wartości
Im większy potencjał redox E 0 OK / Boc , tym bardziej utleniona forma, a odpowiednio zredukowana forma ma słabszą funkcję redukcji. I odwrotnie, im mniejszy E 0 Ok / Vos , tym silniejsza odrestaurowana forma.
Dodatni znak potencjału wskazuje na spontaniczną reakcję redukcji w tandemie z SHE, a ujemna wskazuje na spontaniczną reakcję utleniania. Potencjały silnych środków utleniających będą zawsze dodatnie, a silne środki redukujące będą ujemne.
Tabela potencjałów redoks wskazuje, że fluor cząsteczkowy ma największe właściwości oksydacyjne, a metaliczny magnez ma największe właściwości redukcyjne. Dzięki te jony fluor i magnez praktycznie nie mają odpowiednio właściwości redukujących i utleniających.
Równanie Nernsta
Potencjał układu zależy od stosunków stężeń zredukowanych i utlenionych postaci substancji biorących udział w oddziaływaniu, temperatury otoczenia, właściwości rozpuszczalnika, pH roztworu i innych czynników. Obliczenie potencjału redox, wyrażone przez zależność potencjału od składu roztworu, pokazuje równanie Nernsta:
E Ok / Boc = E 0 Ok / Boc + (RT / nF) x ln (aOk / aBoc), gdzie
- E Ok / Vos - prawdziwa połówkowa reakcja AFP (pary redoks).
- E 0 Ok / Vos - standardowa reakcja połówkowa ORP (pary redoks).
- n to liczba elektronów reakcji OB.
- R = 8,341 J / mol x K (stała gazu molowego).
- F = 96500 C / mol (liczba Faradaya).
- T oznacza temperaturę absolutną (w K).
Odzyskiwanie i utlenianie
Reakcje redoks są określane przez stopień utlenienia i redukcji. Utlenianie odnosi się do procesów, w których atomy, cząsteczki lub jony przekazują elektrony. I odzyskiwanie - gdy atomy, cząsteczki lub jony gromadzą elektrony.
Odpowiednio, utleniacze są substancjami, które przyłączają elektrony (O 2 , halogeny, HNO 3 , KMnO 4 ) i czynniki redukujące, które przekazują elektrony innym atomom podczas procesu redoks (H2, metale, HI). Dostarczając elektrony innym, same środki redukujące są utleniane, a środki utleniające, pobierające elektrony od innych uczestników reakcji, są zmniejszone: 2FeCl2 + Cl2 → 2FeCl3 .
Stan utleniania
Jest to ładunek, który posiadałby atom w związku chemicznym, gdyby elektrony każdego wiązania chemicznego utworzonego przez niego zostały całkowicie przeniesione do bardziej elektroujemnego atomu. Na przykład:
- FeCl2: Fe + 2 , 2Cl -1 ;
- NaH: Na +1 , H- 1 ;
- CCI 4 : C + 4 , 4Cl " 1 ;
- CH 4 : C- 4 , 4H +1 .
OVR może obejmować częściowe lub pełne przejścia elektronów, stopień utlenienia zmian pierwiastków. Obowiązują następujące zasady:
- W prostej substancji stan utleniania atomu wyniesie zero (Cl 2 : 2 Cl 0 ).
- Stopień utlenienia atomów z kompozycji cząsteczki również wynosi zero.
- Stopień utlenienia atomów złożonego jonu będzie równy ładunkowi jonu.
Oznaczanie potencjału redoks gleby
AFP bezpośrednio wpływa na strukturę gleby. Aby zmierzyć, elektroda utknęła w wilgotnym gruncie, a wartość w mV (miliwolty) jest określona na specjalnym urządzeniu. Jednocześnie wiele procesów i reakcji redoks przekształceń aktywnych pierwiastków chemicznych: materii organicznej, manganu, żelaza, siarki i azotu przejawia się w glebach.
Decydujący wpływ na stan gleby wywiera tlen w dwóch postaciach: rozpuszczonej w wilgoci ziemi i atmosferycznej. Są w równowadze. Również w procesach redoks redukuje się substancje mikroorganizmów. Głównymi czynnikami determinującymi ostrość i intensywność AFP są:
- Stopień wilgotności gleby.
- Aktywność mikroflory.
- Napowietrzanie gleby.
- Zawartość materii organicznej.
Wysokie poziomy AFP charakteryzują się glebami automorficznymi:
- Serozem - 350-450 mV.
- Czarnoziem - 400-600 mV.
- Podzol - 550-750 mV.
Kiedy zmniejsza się potencjał irygacyjny.
Wina ORP
W produkcji wina jego istotną cechą jest potencjał redox (redox). Kontrolując potencjał redoks, można regulować lub przynajmniej rozumieć znaczenie procesów "szalejących" podczas dojrzewania materiałów winnych. Są to procesy fermentacji, redukcji i reakcji utleniania.
W kontakcie z tlenem zmieniają się układy samoutleniające, co powoduje zwiększony potencjał. Odpowiednio, im dłuższy etap napowietrzania materiału winnego, tym wyższy jest potencjał redoks. Jeśli dostęp do powietrza zostanie zatrzymany, potencjał stopniowo maleje, osiągając określone wartości, zwane potencjałem krańcowym. Co do zasady, wina napowietrzane mają wskaźniki od 350 do 500 mV, wina dojrzewające bez dostępu powietrza - 100-150 mV. Im dłużej upłynie czas od rozlewania napoju alkoholowego do butelek, tym mniejszy będzie jego potencjał. Należy otworzyć butelkę lub wstrząsnąć, współczynnik mV wzrośnie dramatycznie.
ORP w kosmicznej skali
Normalny potencjał redoks był historycznie czynnikiem decydującym w geologicznej ewolucji Ziemi i innych kosmicznych ciał. Głównym utleniaczem w systemach geologicznych jest tlen. Lotność tlenu (fO 2 ) jest miarą utleniania naturalnych układów, niezależnie od obecności lub nieobecności fazy gazowej zawierającej wolny tlen. Tlenowa lotność kontroluje zachowanie wielu pierwiastków w procesach kondensacji chmury protoplanetarnej, podczas akrecji planet i formowania ich metalowych rdzeni. Ta wiedza pomaga przewidzieć obecność minerałów.
Zastosowanie AFP w praktyce
Pomiar ORP pozwala określić skuteczność dezynfekcji wody, niezależnie od rodzaju stosowanego utleniacza lub mieszaniny związków dezynfekujących i innych czynników. Wynik pomiaru informuje, czy proces dezynfekcji jest naprawdę skuteczny. Pomiar wody ORP może być przeprowadzony w dowolnym punkcie systemu, określając w ten sposób czystość źródła wody, rur, a także instalacji hydraulicznej.
Potencjał redoks na każdym końcu układu powinien być wyższy niż 650 mV. Jeżeli ORP mierzone na końcu systemu jest mniejsze niż na początku systemu, oznacza to, że system zaopatrzenia w wodę nie był dobrze oczyszczony.
Zastosowanie ORP pozwala znaleźć optymalną równowagę między pH a zawartością niezwiązanego chloru. Dokładność przyrządy pomiarowe pozwala obniżyć poziom chloru do takiego, w którym nie ma ryzyka korozji. Na przykład, jeśli ORP wynosi 850 mV, poziom chloru powinien zostać obniżony, aw przypadku, gdy wartość wynosi 600 mV, poziom pH i niezwiązany chlor powinny być sprawdzone i odpowiednio dostosowane poprzez zmniejszenie pH lub zwiększenie obecności chloru.
Technologia ORP stosowana jest w takich obszarach jak uzdatnianie wody (przed i po spożyciu), obróbka metali, dezynfekcja świeżych warzyw i owoców, ozonowanie wody (komercyjne akwaria, dezynfekcja wody), produkcja wina, produkcja wybielaczy, zakłady uboju w fermach drobiu, przemysł papierniczy (wybielanie pulpa), baseny, SPA. Temperatura wody nie wpływa na wartość ORP.

