Redox. Reakcje redoks: opis, przykłady
Reakcje redoks - redoks - reprezentują interakcję przeciwległą. W trakcie tych zjawisk zmieniają się niektóre cechy składników. Te interakcje są realizowane za pomocą metody redystrybucji elektronów. Proces ten zachodzi między utlenianiem atomów i reduktorami. 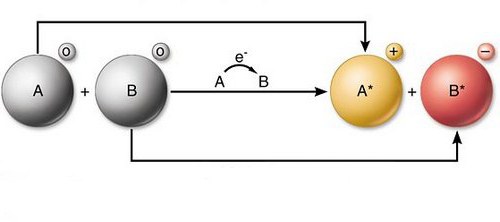
Właściwości komponentu
Chemia organiczna obejmuje zastosowanie szerokiej gamy środków utleniających i redukujących. Pozwala to wybrać konkretny odczynnik o selektywności. Oznacza to, że komponent może wpływać selektywnie na pewne kategorie funkcjonalne. Ponadto dzięki tak szerokiemu wyborowi możliwe jest otrzymanie produktów o określonym stopniu utlenienia. Na przykład borogid Na nie może wchodzić w interakcję z estrami i amidami. Równocześnie redukuje aldehydy lub ketony do alkoholi. Wśród drugiej grupy składników znajdują się również wysoce selektywne związki. Jako przykład, kompleks CrO 3 i pirydyna. Ta struktura utlenia alkohole o wysokiej wydajności do ketonów. W związku z tym nie ma wpływu na komunikację CC. SeO 2 jest również wysoce selektywny. Związek utlenia się aldehydy i ketony do związków alfa-dikarbonylowych.
Informacje ogólne
Reakcje redoks sugerują inną zmianę we właściwościach wchodzących składników. To zależy od charakteru interakcji. Tak więc, podczas redukcji zmniejsza się, a podczas utleniania wzrasta. stan utleniania przedmioty. Początkowo termin został zinterpretowany na tyle, aby zrozumieć. Tak więc, utlenianie uważano za dodanie tlenu, przywrócenie - usunięcie go, odpowiednio. Po wprowadzeniu koncepcji elektronicznych do nauki, definicja została nieco rozszerzona. Od tego czasu koncepcja rozciąga się na interakcje, w których nie bierze udziału tlen. 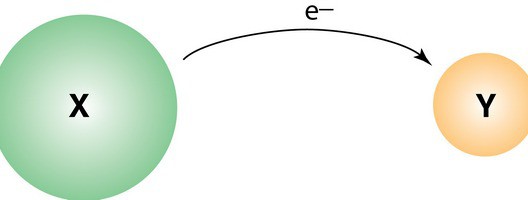
Charakterystyka procesu
Reakcje redoks formalnie reprezentują ruch elektronów. Składniki z atomu jednego odczynnika są przenoszone do atomu innego. Tak więc, utlenianie, w prostych słowach, jest odrzutem elektronów. W niektórych przypadkach proces w cząsteczce w pierwotnej substancji może stać się niestabilny. W rezultacie może rozpaść się na mniejsze elementy, ale z dużą stabilnością. Atomy substancji utlenialnych są zwykle nazywane donorami elektronów, elementami strukturalnymi środka utleniającego są odpowiednio akceptory. Odwrotnie proces przyłączania elektronów przebiega. Nazywa się to przywracaniem. W interakcji tego rodzaju mogą przyjmować różne elementy. Na przykład węgiel, wodór i inne. Różne związki można przywrócić. Na przykład kwasy organiczne w alkohole i aldehydy. 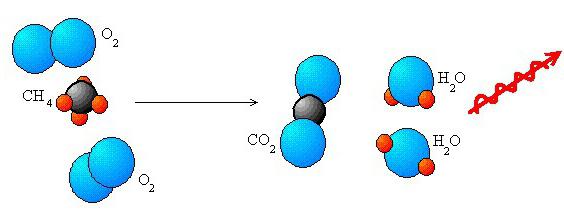
Rodzaje reakcji redoks
Zgodnie z formalnymi cechami rozważanych interakcji dzieli się na wewnątrz- i międzycząsteczkowe. Te ostatnie, na przykład, obejmują 2SO2 + O2 → SO3. Ponadto reakcje redoks są klasyfikowane jako nieproporcjonalne i nieproporcjonalne. W pierwszym przypadku ten sam element ma inne właściwości. Zatem składnik może jednocześnie być zarówno środkiem redukującym, jak i środkiem utleniającym:
Cl 2 + H 2 O → HClO + HCl.
Inny typ - reproporcjonowanie lub proporcja - reprezentuje kilka innych interakcji. W takich reakcjach jeden element wychodzi z dwóch różnych stanów utlenienia dla jednego elementu:
NH 4NO 3 → N 2O + 2H 2O
Procesy katalityczne
Wewnątrz tych interakcji zapewnia wysoką zdolność do selektywności. Tak więc, na przykład, zgodnie z katalizatorem i warunkami, węglowodory acetylenowe można selektywnie poddać uwodornieniu do nasyconego lub etylenu. A redukcja CO2 do CO typu elektrochemicznego w środowisku wodnym w obecności 1,4,8,11-tetraazacyklotetradekanu kompleksu niklu umożliwia prowadzenie procesu przy niższych potencjałach i jednoczesne tłumienie. elektroliza wody podczas tworzenia H2. Ta interakcja ma kluczową wartość w przekształceniu przez CO 2 2 w różne substancje organiczne.
Znaczenie
Redox reakcje katalityczne natura wykonuje ważne zadania w przemyśle. Są one dość rozpowszechnione i używane w inżynierii. Podstawą życia są również reakcje redoks zachodzące podczas transportu elektronów, czynności oddechowej, fotosyntezy. Te interakcje zapewniają większość energii ludzi poprzez spalanie różnych paliw kopalnych. 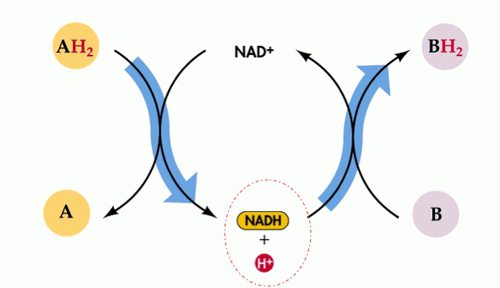
Przepływ interakcji
Często reakcjom redoks towarzyszy zwiększone uwalnianie energii. Pozwala to na ich użycie podczas odbierania, na przykład, energii elektrycznej. Najbardziej gwałtowne interakcje występują przy braku rozpuszczalnika. Jeśli są obecne, reakcje takie mogą nie wystąpić. Może to wynikać z faktu, że jeden lub oba składniki będą reagować z rozpuszczalnikiem. Możemy podać następujący przykład. W roztworze wodnym reakcja 2Na + F2 → 2NaF jest niemożliwa. Wynika to właśnie z faktu, że fluor i sód wyróżniają się silnym oddziaływaniem z H20. Na tworzenie się kompleksów duży wpływ mają właściwości jonów w reakcjach redoks. Tak na przykład dzieje się z [C0 2 + (CN) 6 ] 4 -. Kompleks ten uważa się za silny środek redukujący, w przeciwieństwie do uwodnionego jonu CO 2 +.
Chemia organiczna. Reakcje redoks
W tej dyscyplinie zastosowanie uogólnionych koncepcji i koncepcji dotyczących przebiegu i natury procesu uważa się za bezproduktywne. Jest to szczególnie prawdziwe w przypadku niewielkiej polarności wiązań międzyatomowych. W chemii organicznej zwyczajowo rozważa się utlenianie jako proces zwiększania częstotliwości zawierających kwasy lub zwiększających liczbę wiązań zawierających wodór. W niektórych przypadkach stosuje się podejście, które zakłada, że różne stopnie utlenienia są przypisywane atomom C.

To z kolei zależy od liczby wiązań utworzonych ze składnikiem o wyższej elektroujemności niż wodór. W takim przypadku lokalizacja funkcjonalnych pochodnych będzie przeprowadzana w kolejności rosnących stanów utlenienia. Na przykład nasycone węglowodory należy przypisać do grupy zerowej (Art. Oxid. - 4), ROH, RNH 2 , RCl - do pierwszego (-2), R2CCl2 i R2CO - do 2. (0), RCCl 3 i RCONH 2 - do 3 (+2), CO 2 i CCl 4 - do 4 (+4). W tym przypadku jasne jest, że utlenianie jest procesem, w którym związki przechodzą na wyższy poziom, a redukcja jest procesem odwrotnym. W badaniu interakcji należy zwrócić szczególną uwagę na mechanizmy, za pomocą których zachodzą procesy. Należy zauważyć, że czynniki te są bardzo zróżnicowane. Zatem reakcje mogą zachodzić za pośrednictwem mechanizmu homolitycznego lub heterolitycznego. Jednak w wielu przypadkach procedura przeniesienia jednego elektronu działa jako początkowy etap interakcji. Proces utleniania z reguły charakteryzuje się przepływem w pozycjach o największej gęstości i zmniejszeniem pozycji, w których gęstość elektronów jest minimalna.