Czym jest izomer geometryczny?
Izomeryzm geometryczny to izomeria cis-trans, czyli izomeria EZ. Ich działania opierają się na ograniczonej rotacji podwójnych lub pojedynczych wiązań węglowych w związkach cyklicznych, w cyklicznym połączeniu rotacja pomiędzy pojedynczym wiązaniem węglowym jest ograniczona, a dwie różne grupy są przyłączone do każdej izomerii węgla w podobny sposób. Takie geometryczne izomery często różnią się właściwościami fizycznymi. Wynika to z kształtu izomerów i całkowitego momentu dipolowego. Jeśli dwa atomy o najwyższym priorytecie pozostają po tej samej stronie izomeru, są oznaczone jako Z i jeśli znajdują się po przeciwnej stronie, E.
Krótka historia izomerii
Koncepcja izomerii konstytucyjnej jest znaczącym krokiem naprzód w historii współczesnej chemii, a zwłaszcza w rozwoju chemii organicznej. Pod koniec XVIII wieku wyizolowano kilka czystych substancji, badając chemię "zwierzęcą" i "roślinną". Wielu z nich otrzymało Karl Wilhelm Scheele (1742-1786). Ze względu na dużą różnorodność związków organicznych każda nowa substancja reprezentowała inny skład pierwiastkowy, co odpowiadało uogólnionej obserwacji chemii "mineralnej". Liczba wyizolowanych związków organicznych wzrosła na początku 1800 roku, poprzez identyfikację różnych substancji.
W swojej historii chemii Thomas Thomson napisał w 1830 roku, że:
Berzelius zastosował teorię atomu także do królestwa roślin, po przeanalizowaniu kilku kwasów roślinnych i ukazaniu swojej konstytucji atomowej, ale tutaj pojawia się trudność, której nie możemy pokonać w obecnym stanie naszej wiedzy. Istnieją dwa kwasy, które składają się z dokładnie tych samych atomów. Jak zatem uwzględnić tę uderzającą różnicę we właściwościach? Niewątpliwie na różne sposoby atomy znajdują się w każdym z nich.
Następnie Thomson użył różnych schematów symboli atomowych używanych w tym czasie, aby wyjaśnić, dlaczego dwa kwasy o tym samym składzie pierwiastkowym, związane z izomerami geometrycznymi, mają różne właściwości fizyczne i chemiczne.
Do początku XIX wieku uważano, że te substancje chemiczne występujące w żywych organizmach mają specjalną siłę życiową związaną z żywymi istotami i że są one potrzebne w żywych systemach do reprodukcji. W 1828 Wohler zsyntetyzował próbkę mocznika (NH2) 2CO (również CH4N2O), który był nieodróżnialny od mocznika wyizolowanego z biologicznego moczu.
Przygotował tę "zwierzęcą" substancję z wyraźnie nieorganicznego (mineralogicznego) materiału wyjściowego cyjanianu amonu, (NH4) NCO (również CH4N2O), który jest wynikiem połączenia chlorku amonu i cyjanianu srebra. Tak więc załamała się bariera między "żywym" i "nieożywionym" izomerią.
Oznaczenie izomerów
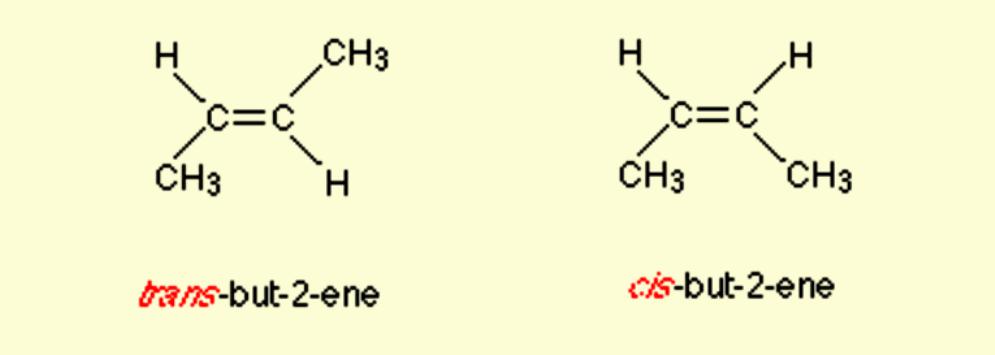
W izomer cis dwie takie grupy pozostają po tej samej stronie podwójnego wiązania, podczas gdy w izomerie trans pozostają w przeciwnym kierunku. Na przykład 2-buten ma dwa izomery cis i trans.
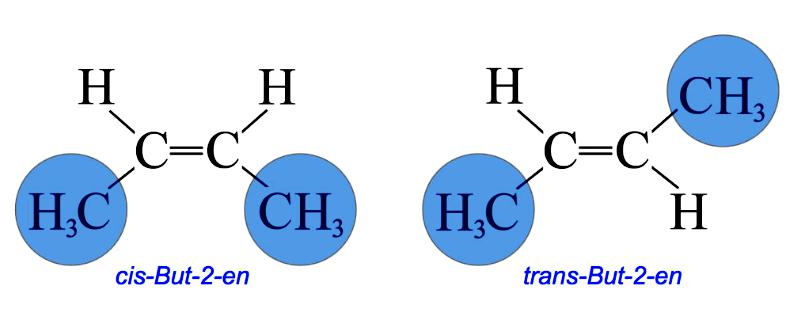
W izomerie cis dwie grupy metylowe i dwie grupy wodorowe pozostają po tej samej stronie podwójnego wiązania, podczas gdy w izomerie trans pozostają w przeciwnym kierunku.
Gdy jedna lub więcej grup połączonych wiązaniem podwójnym nie jest taka sama, izomery są nazywane E lub Z. Aby powiadomić ten typ, użytkownik będzie musiał określić wzory węglowodorów, które mają geometryczne izomery i określić atom o najwyższym priorytecie (najwyższa liczba atomowa) dołączone do każdego wiązania podwójnego C. Jeśli dwa atomy o najwyższym priorytecie pozostają po tej samej stronie izomeru, który jest oznaczony jako Z, i jeśli są one po przeciwnej stronie, są oznaczone jako E.

Na przykład 1 - bromo - 1 - fluoropropan ma dwa izomery. W Z-1 - brom - 1 - fluoropropanie można zauważyć, że brom ma wyższy priorytet lub wyższą liczbę atomową (35) niż fluor (9), które są przyłączone do C-1. Węgiel ma wyższą liczbę atomową (6) niż wodór (1), który jest przyłączony do C-2 tego związku. Ponieważ atomy węgla o najwyższym priorytecie (z grupy -CH3) i bromu przyłączone do tych dwóch atomów węgla są po tej samej stronie, ten związek jest zdefiniowany jako Z. Z drugiej strony w E-1 - brom - 1 - fluoropropan o najwyższym priorytet C i brom znajdują się w odwrotnym kierunku, więc nazywa się to izomerem E.
Podwójne wiązanie węgiel-węgiel
Izomery to dwie cząsteczki, które mają taki sam skład atomowy, ale nie są identyczne. Atomy w dwóch izomerach mogą być połączone w innej kolejności (izomeria strukturalna) lub mogą być połączone w ten sam sposób, ale mają inną orientację - przestrzenny stereoizomerię.
Strukturalny i geometryczny izomer w szczególnych przypadkach, stereoizomer, musi spełniać dwa wymagania:
- W cząsteczce występuje ograniczona rotacja.
- Oba atomy zaangażowane w wiązanie restrykcyjne mają dla nich dwie różne grupy funkcyjne.
Typowym przykładem ograniczonej rotacji jest podwójne wiązanie węgiel-węgiel. Połączenia te obejmują połączenie pi, w większości warunków nie jest opłacalne ich łamanie.
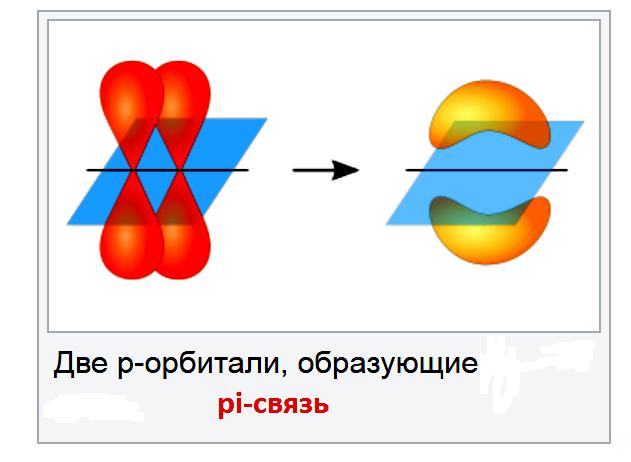
Izomery geometryczne mają strukturę, która wpływa na właściwości fizyczne związku.
System Cis / Trans
Nazewnictwo Cis / Trans to najłatwiejszy w użyciu system połączeń. Najpierw identyfikuje się najdłuższy łańcuch węglowy w cząsteczce, a następnie identyfikowane grupy funkcyjne będące przedmiotem zainteresowania. W izomeru cis obie grupy są po tej samej stronie podwójnego wiązania (cis oznacza "po tej samej stronie" po łacinie). W izomerie trans dwie rozważane grupy znajdują się po przeciwnych stronach podwójnego wiązania (środek trans w całym języku łacińskim). Na przykład dwa różne geometryczne izomery butenu-2.
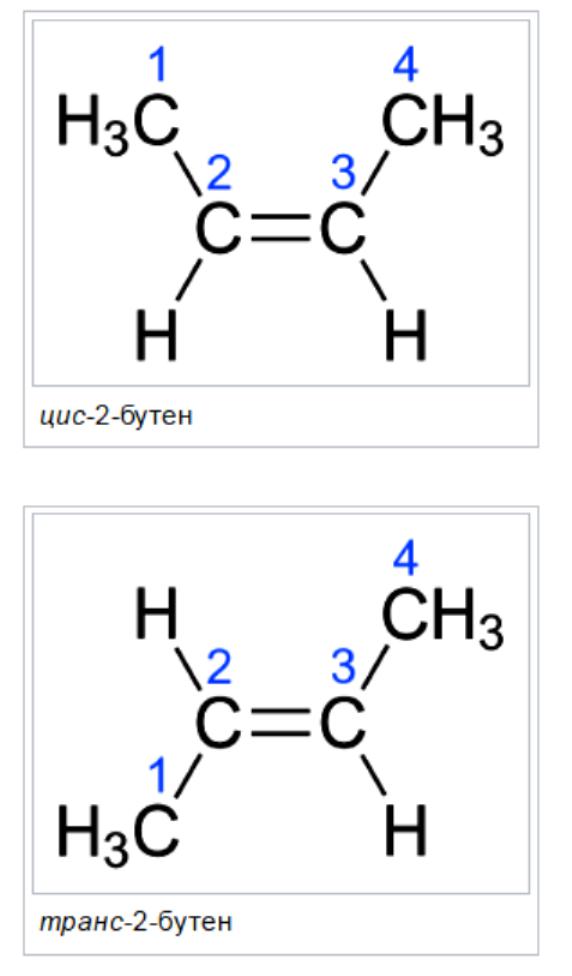
Oba atomy z podwójnym wiązaniem mają te same dwie grupy co te dwie grupy, ale różnią się one od siebie na jednym z podwójnych atomów węgla. Zadanie jest skomplikowane, ponieważ łańcuchy boczne i grupy funkcjonalne stają się bardziej złożone.
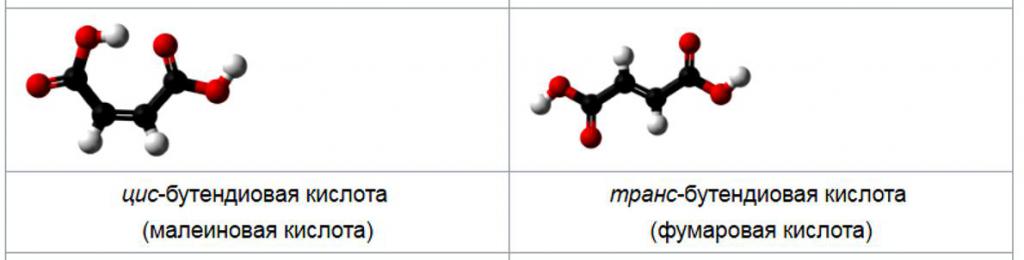
Oficjalna konwencja nazewnictwa IUPAC to E / Z. Nie ma szczególnego związku między cis / trans i E / Z, a oba systemy nie są wymienne. Oznaczenie E / Z wykorzystuje zasady pierwszeństwa Cahn-Ingold-Prelog i jest uważane za bardziej niezawodne. Nazwa IUPAC kwasu fumarowego to izomer trans o wzorze HO2CCH = CHCO2H, a kwas maleinowy jest kwasem cis-butandiowym.
IUPAC to Międzynarodowa Unia Chemii Czystej i Stosowanej, która określa międzynarodowe zasady i standardy dotyczące etykietowania chemikaliów we wszystkich językach.
Związki cykliczne
W połączeniu cyklicznym rotacja pomiędzy wiązaniem pojedynczym węgla jest ograniczona. Tak więc, izomeria jest również możliwa dla tego typu związku, jeśli dwie różne grupy są przyłączone do każdego węgla. Istnieją dwa izomery 1,2-dimetylocyklopropanu.
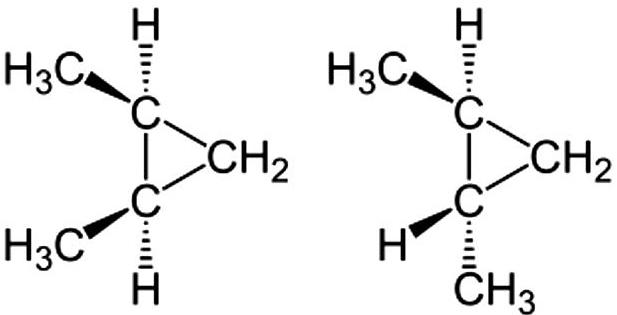
Jednym z nich jest izomer cis, w którym dwie grupy metylowe znajdują się po jednej stronie, a drugi to izomer trans, w którym dwie grupy metylowe znajdują się po drugiej stronie.
Izomery geometryczne różnią się właściwościami fizycznymi. Wynika to z kształtu izomerów i całkowitego momentu dipolowego. Na przykład różnią się temperaturą wrzenia. Temperatura wrzenia izomerów cis i trans 1,2-dichloroetylenu wynosi odpowiednio 60,3 ° C i 47,5 ° C.
W izomerie cis obecność dwóch wiązań dipolowych (C-Cl) daje całkowity dipol cząsteczkowy. Prowadzi to do międzycząsteczkowych oddziaływań dipol-dipol. W przypadku tej siły izomer cis ma wyższą temperaturę wrzenia niż izomer trans, gdzie dwa wiązania dipolowe (C-Cl) są anulowane ze względu na ich położenie w przeciwnym kierunku.
Powodem, dla którego nie jest możliwe obrócenie podwójnego wiązania węgiel-węgiel, jest to, że istnieją dwa wiązania łączące atomy węgla razem i musisz zerwać wiązanie pi. Połączenia Pi powstają podczas bocznego nakładania się p-orbitali. Jeśli spróbuje obrócić podwójne wiązanie węgiel-węgiel, p-orbitale nie będą już ustawione w linii, a zatem wiązanie pi będzie złamane. Energia jest na to wydatkowana, a dzieje się tak tylko wtedy, gdy związek jest bardzo gorący.
Budowa wzorów strukturalnych
Bardzo łatwo jest pominąć ważne elementy geometrycznych izomerów podczas konstruowania wzorów strukturalnych podczas skurczu. Na przykład bardzo kuszące jest rysowanie but-2-ene. Jeśli użytkownik napisze to niepoprawnie, to związek nie będzie już izomerem. Jeśli istnieje nawet najmniejsza wskazówka, że izomer może być użyty, zawsze trzeba stosować związki zawierające podwójne wiązania węgiel-węgiel, pokazujące prawidłowe kąty (120 °) wokół atomów węgla na końcach wiązania. Innymi słowy, musisz użyć formatu pokazanego na rysunku.
Związki zawierające podwójne wiązanie węgiel-węgiel mają ograniczoną rotację. Aby uzyskać izomery, muszą być spełnione następujące warunki:
- ograniczona rotacja, zwykle obejmująca podwójne wiązanie węgiel-węgiel;
- dwie różne grupy po lewej stronie łącza i dwie różne grupy po prawej stronie.
Nie ma znaczenia, czy lewe grupy pokrywają się z prawem czy nie.
Alkenes: Molecular and Structural Formulas
Geometryczne izomery alkenów obejmują pewną liczbę związków, które składają się z atomów C i H w łańcuchu węglowym. Ta grupa obejmuje homologiczną serię o wzorze CnH2n. Najprostszym alkenem jest eten, ma dwa atomy C i wzór C2H4.
Wzór strukturalny dla etenu pokazano na powyższym rysunku. W dłuższych łańcuchach alkenowych dodatkowe atomy węgla są połączone ze sobą za pomocą niektórych wiązań kowalencyjnych. Każdy atom węgla jest również przyłączony do wystarczającej liczby atomów wodoru, aby wytworzyć w sumie cztery pojedyncze wiązania kowalencyjne.
W łańcuchach z czterema lub więcej atomami C, podwójne wiązanie może znajdować się w różnych pozycjach, co prowadzi do tworzenia strukturalnych izomerów. Oprócz izomerów strukturalnych alkeny tworzą również stereoizomery. Ponieważ obrót wokół wiązania wielokrotnego jest ograniczony, grupy przyłączone do atomów z podwójnym wiązaniem zawsze pozostają w tych samych względnych pozycjach.
Te "zablokowane" pozycje pozwalają chemikom zidentyfikować różne izomery z podstawników w celu określenia, która substancja ma geometryczne izomery. Na przykład jeden izomer strukturalny C5H10 ma następujące stereoizomery.
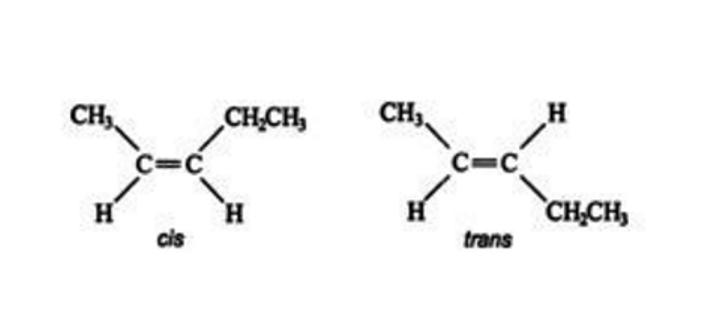
Izomer po lewej stronie, w którym dwa podstawniki (grupy metylowe i etylowe) znajdują się po tej samej stronie podwójnego wiązania, nazywany jest izomerem cis, natomiast izomer po prawej z dwoma podstawnikami innymi niż wodór po przeciwnych stronach to izomer trans.
Na przykład chlor ma pierwszeństwo, ponieważ jest cięższy. Po prawej stronie brom przewyższa węgiel. Po trzecie, określa się pozycje dwóch atomów wyższego rzędu. Jeśli dwa atomy znajdują się w pozycji cis, lokalizacja jest Z (z niemieckiego zusammen, co oznacza "razem"). Jeśli atomy lub grupy znajdują się w pozycji trans, to lokalizacja jest E (z niemieckiego entegegena, co oznacza "przeciwnie").
Twarde związki podwójnego wiązania
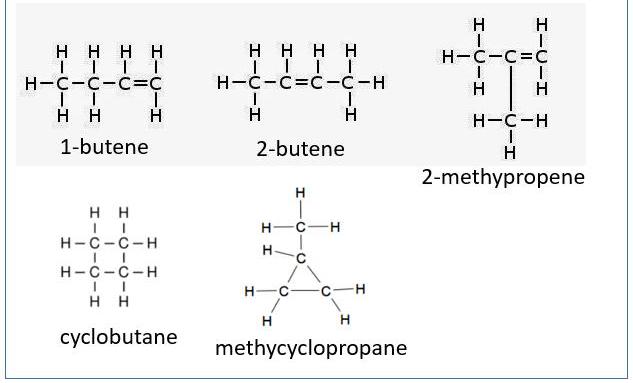
Geometryczne izomery buten to alken z twardym podwójnym wiązaniem. Oznacza to, że w rzeczywistości istnieją cztery izomery, a nie trzy, w pozycji podwójnego wiązania. Istnieją piąte i szóste węglowodory o tym samym składzie, ale nie są alkenami, pomimo tego samego wzoru.
Tworzenie pierścienia cyklobutanu lub metylocyklopropanu zajmuje przestrzeń dwóch atomów wodoru jako podwójne wiązanie, co prowadzi do tego, że mają one formuły identyczne z różnymi butenami.
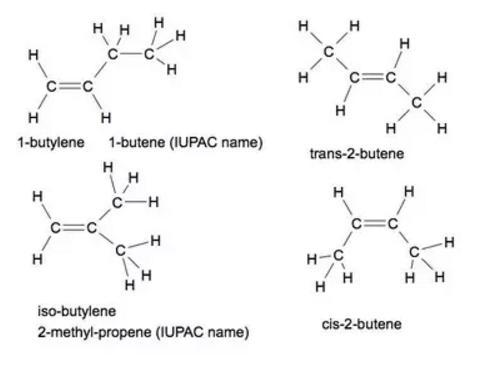
Przykłady izomerów geometrycznych:
- 1-butylen (1-buten);
- izo-butylen (2-metylopropen);
- cis-2-butylen (cis-2-buten);
- trans-2-butylen (trans-2-buten).
Oraz premie: cyklobutan i metylocyklopropan, oba mają ten sam wzór empiryczny jak izomery butenu, ale nie są alkenami. Pierwsza nazwa to "zwykła" lub "banalna" nazwa, a nazwa w nawiasie to nazwa IUPAC.
Izomery butenu
Butene ma wiele zastosowań, od paliwa w samochodzie po torby spożywcze, które setki milionów ludzi na całym świecie noszą codziennie. Wzór chemiczny butenu: C4H8, co oznacza, że składa się z czterech atomów C i ośmiu atomów H, związek odnosi się do alkenu.
Istnieje kilka różnych izomerów lub struktur molekularnych, które mogą tworzyć ten związek (nazwy IUPAC przedstawiono w nawiasach):
- alfa-butylen (but-1-en);
- cis-beta-butylen - ((2Z) -ut-2-ene);
- trans-beta-butylen - ((2E) -ut-2-ene);
- izobutylen (2-metyloprop-1-en).
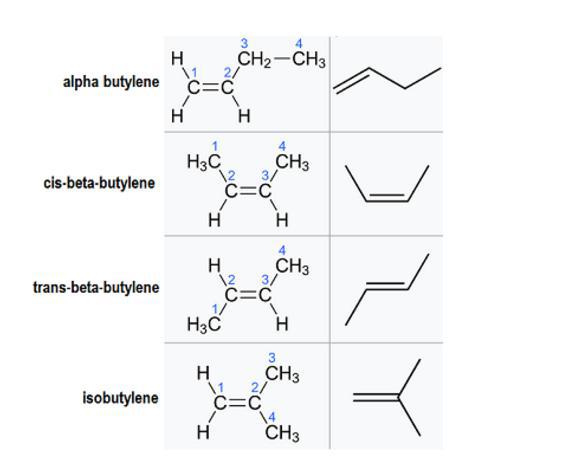
Chociaż wszystkie mają tę samą formułę, ich struktury są różne. Stosunki pomiędzy tymi geometrycznymi izomerami są zasadniczo konstytucyjne, co oznacza, że mają one tę samą formułę molekularną, ale różne wiązania. Wyjątkiem jest cis-beta-butylen i trans-beta-butylen.
Wiele osób wie, że tłuszcze trans są szkodliwe dla ludzi, a tłuszcze nienasycone są dla nich dobre. Jedyna różnica między tymi dwoma tłuszczami polega na tym, że jeden ma trans-link, a drugi ma link cis, jednak to małe zróżnicowanie może znacząco wpływać na funkcję cząsteczki.
W przypadku cis-beta-butylenu i trans-beta-butylenu atomy są w tej samej kolejności, ale polaryzacje są różne. Izomer cis jest polarny, przy czym obie grupy CH3 znajdują się po tej samej stronie. To sprawia, że jest on naprawdę nieporęczny i złożony: izomer trans jest niepolarny, a objętościowe grupy CH3 są zmienne, co daje więcej miejsca w cząsteczce. Ten stosunek nazywa się izomerią cis-trans. Izomery cis są polarne, natomiast izomery trans nie.
Pomimo tego, że każdy z tych izomerów butenu składa się z tych samych materiałów, każdy z nich ma inne właściwości fizyczne. Na przykład punkt wrzenia:
- Cis-beta-butylen: 3,7 ° C
- Trans Beta Butylene: 0,8 ° C.
- Izobutylen: -6,9 ° C.
- Alfa butylen: -6.3 ° C
Materiał do produkcji tworzyw sztucznych
Buteny to alkeny o czterech atomach węgla, C4H8. Istnieje kilka różnych strukturalnych lub konfiguracyjnych izomerów butenu, w tym izomerów geometrycznych i optycznych. Wszystkie cztery buteny mają podobne właściwości fizyczne, są bezbarwne, ciężkie w wodzie, łatwo rozpuszczalne w eterze i alkanach. Różnice we właściwościach fizycznych tłumaczy się strukturą cząsteczek. Na przykład cis-But-2-en ma wyższą temperaturę wrzenia niż trans-But-2-en, ponieważ jest silniejszym dipolem.
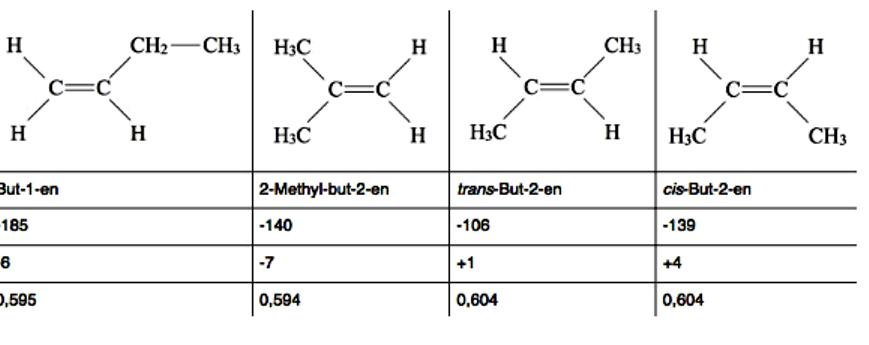
Dwie grupy alkilowe izomeru cis działają z efektem + I w jednym kierunku, a tym samym zwiększają się, podczas gdy dwie grupy alkilowe izomerów trans działają w przeciwnych kierunkach, a zatem osłabiają się nawzajem. Wzory węglowodorów o geometrycznych izomerach są oznaczone normami IUPAC. But-1-en ma tak niską temperaturę topnienia, ponieważ CC jest pojedynczym wiązaniem między drugim i trzecim atomem węgla, swobodna rotacja i grupa etylowa może obracać się wokół osi obrotu we wszystkich kierunkach.
Utrudnia to klasyfikację cząsteczki w stałej strukturze krystalicznej. Pozostałe trzy buteny z podwójnym wiązaniem między drugim i trzecim atomem węgla są bardzo sztywne i można je łatwo sklasyfikować w strukturze krystalicznej. Dlatego mają one stosunkowo wysokie temperatury topnienia. Argumenty te nie zawsze są prawidłowe, ponieważ przykład pokazuje 2-metylo-but-2-en (lub izobuten). Dwie grupy metylowe z ich efektami + I działają w tym samym kierunku, co cis-But-2-en, i faktycznie wymagają poprawy. Jednak izobuten ma bardzo niską temperaturę wrzenia jedynie -7 ° C.
But-1-en i But-2-ene są używane do wytwarzania butadienu i butan-2-olu. Ponadto alkeny są stosowane jako środki alkilujące. Tak więc, ważne paliwo 2,2,4-trimetylo-pentan, lepiej znane jako izooktan, otrzymuje się z izobutenu i izobutanu. Wreszcie, buteny są materiałem wyjściowym do produkcji niektórych tworzyw sztucznych, ponieważ są łatwe w polimeryzacji. Znany plastik na bazie But-1-en, to polibuten-1, z którego wytwarzane są rury.
Pentan, n-pentan, izopentan
Pentan, lub n-pentan, jest jednym z nasyconych węglowodorów alkanowych. Prawie bezwonny n-pentan jest cieczą w warunkach środowiskowych i jest izomerem heraketoitu złożonym z 3 izomerów. Rozgałęzione ciekłe izoalkany C5-C16 są coraz częściej stosowane jako paliwo (Otto, Diesel). Ponadto, te alkany są obecne w olejach grzejnych i olejach smarowych. Zapewniają całkowite spalanie. Zanim poznasz charakterystykę takich związków, musisz podać wzory węglowodorów z izomerami geometrycznymi:
- Stan fizyczny - płyn.
- Kolor - bezbarwny.
- Zapach - prawie nie.
- Łatwo palny.
- Pary mogą tworzyć wybuchowe mieszaniny pod wpływem powietrza.
- Rozpuszczalność w wodzie jest bardzo niska (praktycznie nierozpuszczalna).
- Bardzo niestabilne połączenie.
Imię | N-pentan |
Znak chemiczny | C5H12 |
Masa molowa | 72,1488 kg / kmol |
Temperatura zapłonu | 224 K |
Rozpalaj | 533 bar |
Temperatura wrzenia - 1,013 bara | 309,2 K |
Krytyczna temperatura | 469,8 K |
Ciśnienie krytyczne | 33,6 bar |
Ciepło parowania w temperaturze wrzenia | 357,46 kJ / kg (25,79 kJ / mol) |
Nip | 1,4% objętości (41 g / m3) |
Goo | 7,8% objętości (235 g / m3) |
Wybuch | 9,5 bara |
Najważniejszymi źródłami pentanu są oleje naftowe, które różnią się znacznie składem w zależności od ich pochodzenia. Separacja następuje przez destylację frakcjonowaną. Otrzymuje się następujące frakcje:
- Olej parafinowy (temperatura wrzenia> 320 ° C).
- Olej (temperatura wrzenia 180-250 ° C).
- Ogrzewanie / olej napędowy (temperatura wrzenia od 250 do 320 ° C).
- Benzyna surowa (temperatura wrzenia do około 180 ° C).
- Nafty występują rozgałęzione węglowodory (alkany) od C5 do C10.
- Spalanie pentanu z tlenem (stechiometryczne).
- Końcowymi produktami są dwutlenek węgla i woda. Wzory izomerów geometrycznych: C5H12 + 8O2 ⟹ 5CO2 + 6H2O.
Imię | Postacie | Wartość opałowa HU [MJ / kg] | Wartość opałowa HU [kWh / kg] |
Metan | CH4 | 50,013 | 13,89 |
Ethane | C2H6 | 47,486 | 13,19 |
Propan | C3H8 | 46,354 | 12,88 |
N-butan | C4H10 | 45,715 | 12.70 |
N-pentan | C5H12 | 45,0 | 12,50 |
N-heksan | C6H14 | 44,64 | 12,40 |
N-heptan | C7H16 | 44,64 | 12,40 |
N-oktan | C8H18 | 44,64 | 12,40 |
N-nonan | C 9 H 20 | 44,64 | 12,40 |
N-dziekan | C10H22 | 44,64 | 12,40 |
Geometryczny izomer penten-2 jest uniwersalnym rozpuszczalnikiem. Służy do spieniania żywicy fenolowej i polistyrenu. Jest on również wymagany jako substancja referencyjna w chromatografii gazowej oraz jako propelent w butlach natryskowych.