Czynnikiem utleniającym jest atom akceptujący elektrony.
Środek utleniający i środek redukujący są stosowane do formułowania reakcji w chemii organicznej i nieorganicznej. Rozważmy główne cechy takich interakcji, identyfikujemy algorytm kompilacji równania i rozmieszczenia współczynników.

Definicje
Utleniacz jest atomem lub jonem, który podczas interakcji z innymi pierwiastkami akceptuje elektrony. Proces wytwarzania elektronów nazywa się redukcją i wiąże się ze spadkiem stopnia utlenienia.
W trakcie chemia nieorganiczna Rozważono dwie główne metody ustalania współczynników. Środek redukujący i środek utleniający w reakcjach są określane przez wytwarzanie bilansu elektronowego lub metodą połowicznej reakcji. Zastanowimy się nad pierwszą metodą umieszczania współczynników w OVR.
Stany utleniania
Przed oznaczeniem utleniacza w reakcji należy umieścić stany utleniania wszystkie elementy w substancjach uczestniczących w transformacji. Reprezentuje ładunek atomu elementu obliczony według pewnych reguł. W złożonych substancjach suma wszystkich dodatnich i ujemnych stanów utlenienia powinna wynosić zero. W przypadku metali z głównych podgrup odpowiada wartościowości i ma wartość dodatnią.
W przypadku niemetali, które znajdują się we wzorze na końcu, stopień jest określany przez odjęcie numeru grupy od ośmiu i ma wartość ujemną.
Dla substancji prostych jest równa zero, ponieważ nie ma procesu akceptacji lub uwalniania elektronów.
W przypadku złożonych związków składających się z kilku pierwiastków chemicznych, do określenia stopnia utlenienia stosuje się obliczenia matematyczne.
Tak więc utleniacz jest atomem, który w procesie oddziaływania obniża jego stan utlenienia, a środek redukujący wręcz przeciwnie, zwiększa jego wartość.
Przykłady iad
Główną cechą zadań związanych z rozkładem współczynników w reakcjach redoks jest definicja substancji opuszczonych i formułowanie ich formuł. Czynnik utleniający jest pierwiastkiem, który przyjmuje elektrony, ale oprócz tego czynnik redukujący, który je oddaje, musi uczestniczyć w reakcji.
Podajemy uogólniony algorytm, dzięki któremu można wykonywać zadania oferowane absolwentom szkół średnich w jednym egzaminie państwowym. Rozważmy kilka konkretnych przykładów, aby zrozumieć, że utleniacz jest nie tylko pierwiastkiem w złożonej substancji, ale także prostą substancją.
Po pierwsze, konieczne jest ustawienie wartości stanów utlenienia dla każdego elementu za pomocą określonych reguł.
Następnie należy przeanalizować elementy, które nie brały udziału w tworzeniu substancji i stworzyć dla nich formułę. Po wyeliminowaniu wszystkich luk można przystąpić do procesu obliczania równowagi elektronowej między środkiem utleniającym a środkiem redukującym. Otrzymane współczynniki są wprowadzane do równania, jeśli to konieczne, dodając je do substancji, które nie są zawarte w bilansie.
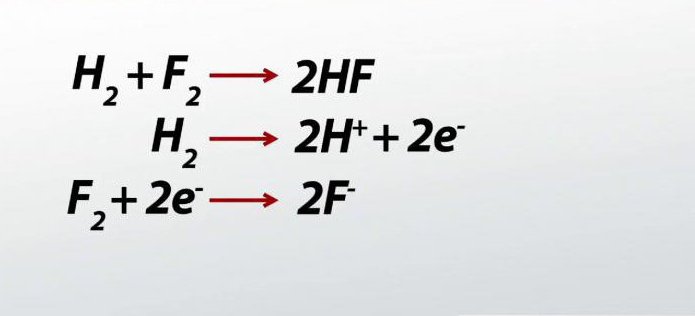
Na przykład, używając metody balansu elektronicznego, konieczne jest uzupełnienie proponowanego równania, umieszczenie niezbędnych współczynników przed wzorami.
H 2 O 2 + H 2 SO 4 + KMnO 4 = MnSO 4 + O 2 + ... + ...
Na początek określimy wartości stanów utlenienia, które otrzymamy
+K + Mn +7 O 4 -2 = Mn +2 S +6 O 4 -2 + O 2 0 + …+… H 2+ O 2 - + H 2+ S +6 O 4 -2 + K + Mn + 7 O 4 -2 = Mn + 2 S +6 O 4 -2 + O 2 0 + ... + ...
W proponowanym schemacie różnią się tlenem, a także manganem w nadmanganian potasu. Zatem, środek redukujący i środek utleniający są przez nas znalezione. W prawej części nie ma substancji, w której byłby potas, dlatego zamiast pominięć, tworzymy formułę jego siarczanu.
Następnie zapisujemy bilans elektroniczny. Tlen w tym przypadku będzie wykazywał właściwości redukujące, dając dwa elektrony. Mangan bierze je, wykazując zdolność utleniającą.
Ostatnim krokiem w tym zadaniu jest ustawienie współczynników.
5H 2O 2 + 3H 2SO 4 + 2KMnO 4 = 2Mn SO 4 + 5O 2 + 8H 2O + K 2 SO 4
Kwasy, nadmanganian potasu, nadtlenek wodoru. Wszystkie metale wykazują właściwości redukujące, zmieniając się w reakcje w kationy o ładunku dodatnim.
Wniosek
Procesy związane z akceptacją i uwalnianiem ujemnych elektronów występują nie tylko w chemii nieorganicznej. Metabolizm, który jest przeprowadzany w żywych organizmach, jest wyraźnym wariantem przebiegu reakcji redoks w chemii organicznej. Potwierdza to znaczenie rozważanych procesów, ich znaczenie dla natury ożywionej i nieożywionej.