Jakie są halogeny w chemii?
Porozmawiajmy o halogeny. Są w siódmej grupie (głównej podgrupie) układu okresowego. W tłumaczeniu z języka greckiego "halogen" oznacza "rodzenie soli". Artykuł będzie mówił o tym, co stanowi chemiczny halogen, które substancje są łączone pod tym terminem, jakie są ich właściwości i cechy produkcji.

Funkcje specjalne
Mówiąc o halogenach, zwracamy uwagę na specyficzność struktury ich atomów. Wszystkie elementy na zewnętrznym poziomie energii mają siedem elektronów, a jeden z nich jest niesparowany (wolny). Dlatego utleniające właściwości halogenu są wyraźne, to jest dodanie jednego elektronu podczas interakcji z różnymi substancjami, co prowadzi do całkowitego ukończenia zewnętrznego poziomu energii, tworzenia stabilnych konfiguracji halogenków. W przypadku metali tworzą one bryłę wiązanie jonowe charakter

Przedstawiciele halogenów
Obejmują one następujące elementy: fluor, chlor, brom, jod. Astatis i tennesin mają z nimi formalny związek. Aby zrozumieć, czym są halogeny, należy zauważyć, że chlor, brom i jod mają wolne orbitowanie. To ona wyjaśnia różne stany utleniania dla tych przedmiotów. Na przykład chlor ma następujące wartości: -1, + 1, + 3, +5, +7. Gdy atom chloru otrzymuje dodatkową energię, następuje stopniowe przejście elektronów, co tłumaczy zmiany stopnia utlenienia. Do najbardziej stabilnych konfiguracji chloru należą jego związki, w których stopień utlenienia wynosi -1, a także +7.

Będąc w naturze
Cechy struktury wyjaśniają jej występowanie w przyrodzie. Związki halogenowe w przyrodzie są reprezentowane jako halogenki, wysoce rozpuszczalne w wodzie. Wraz ze wzrostem atomowego promienia fluorowca maleje ich ilościowa zawartość w skorupie ziemskiej. Na przykład niektóre związki bromu, chloru, fluoru są stosowane w objętościach przemysłowych.
Fluorek wapnia (fluoryt) można wymienić jako główny związek fluoru obecny w przyrodzie.
Cechy pokwitowania
Aby zrozumieć, czym są halogeny, należy dowiedzieć się, jak je uzyskać. Główną opcją wydzielania czystych halogenów z soli jest elektroliza stopionych soli. Na przykład, gdy jest wystawiony na działanie chlorek sodu bezpośredni prąd elektryczny, ponieważ produkty reakcji można rozpatrywać nie tylko jako gazowy chlor, ale także metaliczny sodu. Metal zostaje zredukowany na katodzie, a na anodzie powstaje halogen. Aby uzyskać brom za pomocą wody morskiej, prowadzenie elektrolizy tego roztworu.
Właściwości fizyczne
Zastanówmy się nad właściwościami fizycznymi przedstawicieli siódmej grupy głównej podgrupy. Fluor w normalnych warunkach jest substancją gazową, która ma jasnożółty kolor, ostry i drażniący zapach. Gazowy i żółto-zielony chlor z ostrym, duszącym bursztynem. Brom jest brązowym ciężkim płynem. Ze wszystkich fluorowców tylko jod jest fioletową substancją krystaliczną.
Fluor jest najsilniejszym czynnikiem utleniającym. W grupie zdolność przyłączania elektronu podczas reakcji chemicznej stopniowo zmniejsza się z fluoru do astatu. Powodem osłabienia tej właściwości jest zwiększenie promienia atomowego.
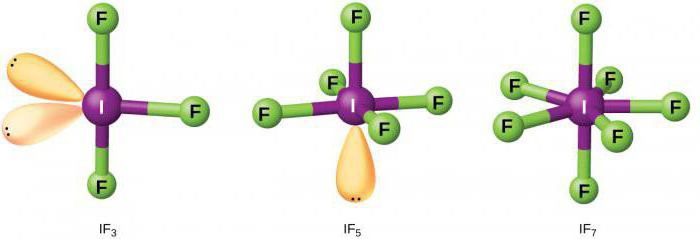
Cechy właściwości chemicznych
Fluor, będący najsilniejszym utleniaczem, może reagować bez dodatkowego ogrzewania prawie wszystkimi niemetalami. Procesowi towarzyszy wydzielanie dużej ilości ciepła. W przypadku metali proces ten charakteryzuje się samozapłonem fluoru.
Ponieważ ten fluorowiec charakteryzuje się wysoką aktywnością chemiczną, jest w stanie oddziaływać w kontakcie z gazami szlachetnymi.
Fluor wchodzi w interakcję ze złożonymi substancjami. Aktywność bromu jest znacznie niższa. Stosowany jest głównie w chemii organicznej do przeprowadzania jakościowych reakcji na związki nienasycone.
Jod wchodzi w interakcję z metalami tylko po podgrzaniu, a proces charakteryzuje się absorpcją energii (reakcja egzotermiczna).
Funkcje użytkowania
Jaka jest wartość halogenów? Aby odpowiedzieć na to pytanie, należy rozważyć główne obszary ich zastosowania. Na przykład naturalny mineralny kriolit, który jest związkiem glinu, fluoru, sodu, jest stosowany jako dodatek do pasty do zębów, aby zapobiec próchnicy zębów.
Chlor w dużych ilościach stosowany do produkcji kwasu solnego. Ponadto, ten halogen jest poszukiwany w produkcji tworzyw sztucznych, rozpuszczalników, barwników, gum, włókien syntetycznych. Duża ilość związków zawierających chlor jest stosowana do skutecznego zwalczania różnych szkodników upraw rolnych. Chlor, a także jego związki, są również niezbędne do bielenia tkanin bawełnianych i lnianych, papieru i dezynfekcji wody pitnej. Brom i jod stosowane są w przemyśle chemicznym i farmaceutycznym.
Ostatnio do czyszczenia czystej wody używano ozonu zamiast chloru.
Działanie biologiczne
Wysoka reaktywność halogenu wyjaśnia fakt, że wszystkie te związki są truciznami, które mają działanie dusicielskie i są zdolne do uszkadzania tkanki organicznej. Pomimo tych cech te elementy są niezbędne dla procesów życiowych ludzkiego ciała.
Na przykład, fluor jest zaangażowany w procesy metaboliczne w komórkach nerwowych, mięśniach, gruczołach. W codziennym życiu naczynia teflowe są coraz powszechniejsze, a fluor jest jednym z jego składników.
Chlor wspomaga wzrost włosów, stymuluje procesy metaboliczne, zapewnia siłę i wigor. Maksymalna jego ilość w postaci chlorku sodu jest częścią osocza krwi. Wśród związków tego pierwiastka o szczególnym znaczeniu z biologicznego punktu widzenia jest kwas chlorowodorowy.
To, że jest podstawą soku żołądkowego, bierze udział w procesach dzielenia żywności. Aby organizm normalnie funkcjonował, człowiek musi spożywać co najmniej dwadzieścia gramów dziennie. sól.
Wszystkie chlorowce są niezbędne dla osoby do aktywności życiowej, a także są wykorzystywane przez niego w różnych dziedzinach działalności.